
- •Визначення фізичних характеристик твердих сипучих хімічних реагентів
- •1.Теоретичні основи
- •2.Хімічні реактиви, прилади, посуд
- •3.Опис лабораторної установки
- •4.Послідовність виконання роботи
- •5.Опрацювання результатів
- •Одержання сульфату амонію
- •1.Теоретичні основи
- •2.Хімічні реактиви, прилади та посуд
- •3. Опис лабораторної установки
- •4.Послідовність виконання роботи
- •5.Опрацювання результатів
1.Теоретичні основи
Сульфат амонію отримують на основі реакції нейтралізації сірчаної кислоти аміаком.
Сульфат амонію являє собою білі, прозорі, тонкі кристали з формою подовженого ромба. Розмір кристалів залежить від умов їх утворення і може коливатися від сотенних частків мм до 4мм і більше. Питома вага кристалічного сульфату амонію складає 1.77 г/см3 . Сульфат амонію знаходить широке застосування у сільському господарстві в якості добрива. По вмісту азоту сульфат амонію стоїть на одному з перших місць серед других азотних добрив. Так, сульфат амонію містить 21.5% азоту, селітра чилійська –15.5%. Для характеристики сульфату амонію як добрива велике значення має розмір його кристалів. Дуже дрібні кристали легко розносяться вітром і у грунті розподіляються неравномірно. Дрібні кристали важко відділити від вологи, тому вони легко злежуються, що ускладнює введення їх у грунт. Виробництву сульфату амонію з великими кристалами приділяють значну увагу. Сульфат амонію з аміаку коксового газу одержують в апараті названому сатуратором. У сатураторах коксовий газ барботують через розчин сірчаної кислоти Аміак при цьому вступає в реакцію з кислотою, і утворює як продукт нейтралізації, сульфат амонію. При надлишку кислоти утворюється кисла сіль - бісульфат амонію:
3NH3+2H2SO4=NH4HSO4+(NH4)2SO4 (2.1)
В міру насичення розчину аміаку кисла сіль переходить у середню, тобто в сульфат амонію:
NH4HSO4+NH3=(NH4)2SO4 (2.2)
Реакція між аміаком і сірчаною кислотою супроводжується виделенням тепла. Кількість тепла, що виділяється, має велике значення для процесу виробництва. На кожен кілограм сульфату амонію, що утворився виділяється близько 20000 кДж. У сатураторі одночасно утворюються сульфат і бісульфат амонію. Бісульфат амонію краще розчинний у воді і слабкому розчині сірчаної кислоти, чим сульфат амонію і тому при досягненні насичення розчину в першу чергу випадають кристали сульфату амонію.
Кристали сульфату амонію осідають на дно сатуратора, і відтіля безупинно відкачуються разом з маточним розчином відцентровим насосом у кристалоприймач. З кристалоприймача маточий розчин стікає в сатуратор, а кристали поступають на центрифугу. Оптимальна температура процесу 60-70 0С.
2.Хімічні реактиви, прилади та посуд
Реактиви:
Насичений розчин (NН4)2S04.
20 % розчин аміачної води.
75 % розчин сірчаної кислоти.
0,5 мол/дм3 розчин сірчаної кислоти.
0.5 мол/дм3 розчин NaОН.
Метилоранж.
Прилади і матеріали:
Нейтралізатор на 250 см3.

Поглинальна склянка (2 шт.).
Термометр на 100
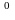 С.
С.Мірна колба на 100 см3
Бюкс.
Піпетка на 10 см3.
Колба Ерленмейєра на 250 см3.
Колба Бунзена, лійка Бюхнера.
Фільтрувальний папір.
3. Опис лабораторної установки
Нейтралізацію розчину сірчаної кислоти проводять сумішшю аміака з повітрям. Як нейтралізатор (1) застосовується конічна колба закрита пробкою з трьома отворами в які вставлені термометр і дві трубки для вводу і виводу суміші аміку з повітрям. Через поглинальну склянку (2), де знаходиться розчин аміаку, відсисається повітря, яке насичається аміаком і надходить у нейтралізатор (1). Далі повітря з залишками аміаку донейтралізуються у склянці (3), де розташован розчин 1М Н2SO4. До відводу склянки (3) приєднан водоструминний насос яким відсмоктують повітря.

1 – нейтралізатор; 2 - поглинальна склянка; 3 – склянка донейтралізатор
Рисунок 2.1 - Схема лабораторної установки
