
- •Издание второе, переработанное и дополненное
- •Пяткин Кирилл Дмитриевич, Маркова Надежда Степановна, Трофимова Нина Дмитриевна Руководство к практическим занятиям по медицинской микробиологии
- •Издательство «Медицинаэ Москва, ПетроверигскиЯ пер., 6/8 Заказ 7. 11-я типография Главполиграфпрома Комитета по печати при Совете Министров ссср. Москва, Нагатинская ул., д. 1. Цена 72 коп.
- •Микробиологическая лаборатория и ее оборудование. Принципы устройства микроскопов и правила микроскопии Микробиологическая лаборатория и ее оборудование
- •Принципы устройства микроскопов и правила микроскопии
- •Задания
- •Методика приготовления препаратов (мазков) и простые способы окраски. Морфология и строение бактерий (изучение основных форм)
- •2 Заказ ш 7
- •Феноловый фуксин Циля
- •Фуксин Пфейффера
- •Метиленовый синий (тиазин-тетраметил-тионин)
- •Задания
- •Задания
- •Способ Нейссера
- •Морфология и строение актиномицетов и спирохет Морфология и строение актиномицетов
- •Морфология и строение спирохет
- •Задания
- •Морфология и строение вирусов
- •Задания
- •Морфология и строение грибов
- •Задания
- •Морфология и строение простейших
- •Задания
- •Методы стерилизации
- •Культивирование микроорганизмов. Методы посева и выделения чистых культур аэробных бактерий
- •Методы посева чистых культур аэробных бактерий
- •Выделение чистых культур аэробных бактерий
- •Задания
- •Методы выделения чистых культур аэробных бактерий (продолжение). Культивирование и выделение чистой культуры анаэробных бактерий
- •Выделение чистых культур аэробных и анаэробных бактерий (продолжение). Изучение ферментативных свойств бактерий
- •Методы культивирования и выделения риккетсии
- •Методы культивирования и выделения вирусов
- •Задания
- •Действие физических и химических факторов а микроорганизмы. Санитарно-бактериологическое исследование почвы, воды и воздуха
- •Санитарно-бактериологическое исследование почвы, воды и воздуха
- •3 Адания
- •Микрофлора тела человека
- •Действие биологических факторов на микроорганизмы
- •Задания
- •Методические указания о правилах взятия некоторых материалов для микробиологического исследования
- •Задания
- •Задания
- •Задания
- •Задания
- •Получение диагностических сывороток
- •Взаимодействие токсина с антитоксином
- •Реакция преципитации
- •Задания
- •Реакции агглютинации
- •Реакция лизиса и гемолиза
- •Задания
- •Реакция связывания комплемента
- •Реакция фагоцитоза
- •Приготовление и применение вакцин
- •Задания
- •Получение и применение лечебных сывороток
- •Аллергические пробы
- •Лабораторная диагностика стафилококковых и стрептококковых инфекций Лабораторная диагностика стафилококковых болезней
- •Лабораторная диагностика стрептококковых болезней
- •Лабораторная диагностика инфекций, вызываемых пневмококками
- •Задания
- •Лабораторная диагностика эпидемического менингита, гонореи и бленнореи Лабораторная диагностика эпидемического менингита
- •Лабораторная диагностика гонореи и бленнореи
- •Лабораторная диагностика туляремии
- •Лабораторная диагностика бруцеллеза
- •Лабораторная диагностика инфекций, вызываемых escherichia coli. Лабораторная диагностика брюшного тифа, паратифов а и в
- •Задания
- •Лабораторная диагностика холеры
- •Задания
- •Задания
- •Лабораторная диагностика сибирской язвы
- •Задания
- •Задания
- •Свойства дифтерийных и непатогенных коринебактерий
- •Задания
- •Лабораторная диагностика туберкулеза
- •Задания
- •Лабораторная диагностика актиномикоза и трепанематозов Лабораторная диагностика актиномикоза
- •Лабораторная диагностика сифилиса
- •Лабораторная диагностика лептоспирозов
- •Задания
- •Лабораторная диагностика болезней, вызываемых риккетсиями
- •Задания
- •Лабораторная диагностика вирусных инфекций
- •Задания
- •Лабораторная диагностика полиомиелита
- •Лабораторная диагностика Коксаки и echo
- •19 Заказ № 7
- •Задания
- •Задания
- •Лабораторная диагностика дерматомикозов
- •Задания
- •Лабораторная диагностика инфекций, вызываемых простейшими
- •Лабораторная диагностика малярии
- •Лабораторная диагностика лейшманиозов
- •Лабораторная диагностика токсоплазмоза
- •Лабораторная диагностика амебиаза
- •Задания
- •Физиология микроорганизмов
Принципы устройства микроскопов и правила микроскопии
В настоящее время микробиологические лаборатории используют не только обычные методы оптической микроскопии в проходящем свете, но и специальные: в темном поле зрения, фазовоконтрастный, люминесцентный и электронный.
Световой микроскоп *. Наиболее важной оптической частью микроскопа являются объективы, которые по степени увеличения и способу использования делят на сухие и иммерсионные.
Сухие объективы с относительно большим фокусным расстоянием и слабым увеличением обычно применяют для изучения крупных биологических и гистологических объектов. Иммерсионные, или погружные, объективы имеют неболь-
1 Более подробно устройство микроскопа изучается на кафедре физики.
8
под контролем глаза в масло, смотрят в окуляр и устанавливают вначале макровинтом, а потом микровинтом четкое изображение объекта. Левая рука должна находиться на микрометрическом винте в течение всего наблюдения. Левым глазом, не закрывая правого, изучают препарат (рис. 3). С помощью бинокуляра (насадка с двумя тубуса-
шое фокусное расстояние, их используют главным образом при изучении микроорганизмов.
Мри микроскопии иммерсионным объективом обязательным условием является погружение объектива в масло, по-казатель преломления которого близок показателю прелом-ления стекла (1,52). Для этих целей применяют: кедровое,
J
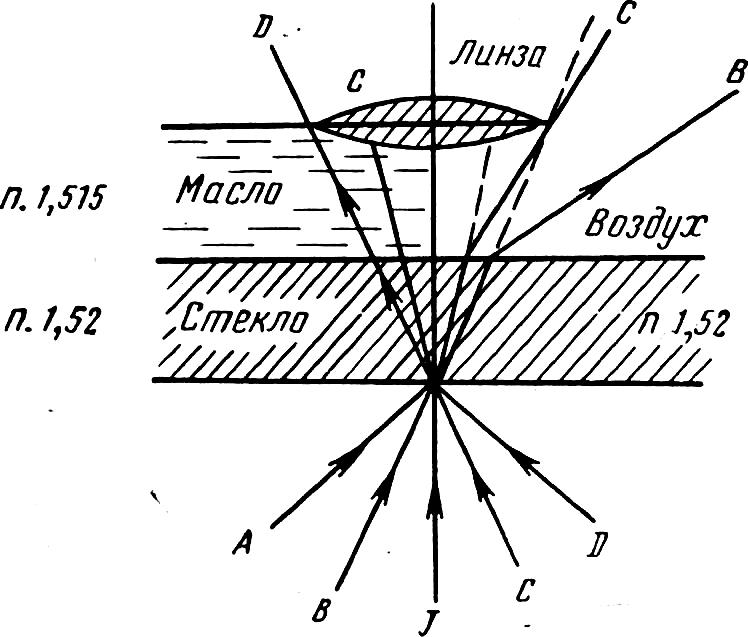
Рис. 2. Ход лучей при прохождении их через иммерсионное масло и воздух (буквы обозначают ход лучей).
персиковое масло, «иммерсиол», состоящий из персикового масла, канифоли, нафталинами салола. В этом случае пучок света, вышедший за пределы предметного стекла, не рассеивается, и лучи, не меняя своего направления, попадают в объектив (рис. 2).
Разрешающая способность иммерсионного объектива находится в пределах 0,2 \х. Максимальное увеличение современных микроскопов достигает 2000—3000.
При использовании иммерсионного объектива вначале центрируют оптическую часть микроскопа. Если тубус мик-роскопа раздвижной, то его устанавливают на длину 160 мм, -..нем поднимают конденсор до уровня предметного столика, Полностью открывают диафрагму, устанавливают объек-ТИВ 8 и при помощи плоского зеркала освещают поле зрения. Работая с конденсором Аббе, независимо от источника гнета, необходимо применять только плоское зеркало. На предметное стекло с окрашенным препаратом наносят каплю масла, иммерсионный объектив погружают осторожно
9
сор заменяют специальным параболлойд-конденсорбМ (рис. 4), в котором центральная часть нижней линзы затемнена, а боковая поверхность зеркальная. Этот конденсор задерживает центральную часть параллельного пучка лучей, образуя темное поле зрения. Краевые лучи проходят через кольцевую щель, падают на боковую зеркальную поверхность конденсора, отражаются от нее и концентрируются в
 ми
и окулярами) микроскопирование производят
одновременно обоими глазами. По
окончании работы поднимают тубус,
снимают препарат, затем салфеткой,
прикрепленной к колонке микроскопа,
удаляют масло с объектива и отводят
его в сторону. Салфетку укладывают на
предметный столик, опускают конденсор
и тубус.
ми
и окулярами) микроскопирование производят
одновременно обоими глазами. По
окончании работы поднимают тубус,
снимают препарат, затем салфеткой,
прикрепленной к колонке микроскопа,
удаляют масло с объектива и отводят
его в сторону. Салфетку укладывают на
предметный столик, опускают конденсор
и тубус.
Для фотографирования микропрепаратов имеются микроскопы (МБИ-6), снабженные постоянной фотокамерой.
Микроскопию в темном поле зрения в отличие от обычной производят при боковом освещении; она относится к ультрамикроскопическим методам. В темном поле зрения наблюдают живые объекты величиной 0,06—0,04 — 0,02 jli. Чтобы получить яркое боковое освещение, обычный конден
10
 его
фокусе. Если же на пути луча нет каких-либо
частиц, то он преломляется, падает на
боковую зеркальную поверхность,
отражается от нее и выходит из конденсора.
Когда луч встречает на своем пути
микробные клетки и другие оптически
не гомогенные вещества, то свет в
препарате отражается от них и попадает
в объектив. Микробные клетки и другие
объекты в этом случае ярко светятся.
его
фокусе. Если же на пути луча нет каких-либо
частиц, то он преломляется, падает на
боковую зеркальную поверхность,
отражается от нее и выходит из конденсора.
Когда луч встречает на своем пути
микробные клетки и другие оптически
не гомогенные вещества, то свет в
препарате отражается от них и попадает
в объектив. Микробные клетки и другие
объекты в этом случае ярко светятся.
Источником искусственного света служит осветитель ОИ-7 или лампа 100—150 W в металлическом футляре. Для бокового освещения необходим параллельный пучок света, поэтому применяется только плоское зеркало микроскопа.
Правила микроскопии в темном поле зрения. Обычно исследуют материал сухой системой (объектив 40). Небольшую каплю изучаемого материала помещают на предметное стекло (толщина не более 1,1 мм) и накрывают покровным стеклом (толщина 0,17 мм), не допуская образования пузырьков воздуха. На верхнюю линзу
11
конденсора наносят кайлю иммерсионного масла, которое должно заполнить пространство между конденсором и предметным стеклом.
При микроскопии иммерсионной системой используют специальный объектив с диафрагмой и этим задерживают лучи, беспрепятственно проходящие через гомогенную среду.
Микроскопия в темном поле зрения применяется для обнаружения возбудителей сифилиса, возвратного тифа, леп-тоспирозов и других болезней, а также для изучения подвижности микробов. Однако в темном поле зрения нельзя хорошо изучить форму и тем более внутреннее строение микроорганизмов. Для этой цели предложены видоизмененные методы оптической микроскопии.
Фазовоконтрастная микроскопия основана на том, что оптическая длина пути света в любом веществе зависит от показателя преломления. Это свойство используют с целью увеличения контрастности изображения прозрачных объектов.
Световые волны, проходя через оптически более плотные участки объекта, отстают по фазе световых волн, не проходящих через эти участки. При этом интенсивность света не меняется, а только изменяется фаза колебания, не улавливаемая глазом и фотопластинкой. Препараты, не изменяющие амплитуду светового луча, а только фазу его колебания, называют «фазовыми». Для повышения контрастности изображения фазовые колебания при помощи специальной оптической системы превращаются в амплитудные, хорошо улавливаемые глазом. Препараты в светлом поле зрения становятся резко контрастными — положительный контраст (рис. 5), при отрицательном фазовом контрасте на темном фоне виден светлый объект.
Фазовоконтрастная микроскопия не увеличивает разрешающей способности оптической системы, но помогает выявить новые детали структуры живых микробов, изучить различные стадии их развития, влияние химических агентов, антибиотиков и других факторов.
Для фазовоконтрастной микроскопии используют следующие приспособления: 1) специальные объективы ахроматы (Ф10, Ф20, Ф40 и масляная иммерсия ФОИ90); 2) фазовый конденсор с револьвером и специальными диафрагмами для каждого объектива; 3) вспомогательный микроскоп малого увеличения; 4) осветитель ОИ-7; 5) светофильтры (лучше пропускающие зеленые лучи).
12
А ноптральный
микроскоп. Устройство
этого микроскопа основано на принципе
использования фазовоконтрастной
микроскопии. Одной из важнейших деталей
прибора является линза объектива,
расположенная вблизи его «выходного»
зрачка, на которую нанесен слой
копоти или меди, поглощающий не менее
10% света. Благодаря этому фон поля
зрения приобретает коричневый цвет,
микроскопируемые объекты имеют различные
оттенки — от белого до золотисто-коричневого.
Ход лучей света изображен на рис. 6.
Аноптральный микроскоп применяют
для исследования живых малоконтрастных
объектов: простейших, трепонем и
некоторых вирусов.
ноптральный
микроскоп. Устройство
этого микроскопа основано на принципе
использования фазовоконтрастной
микроскопии. Одной из важнейших деталей
прибора является линза объектива,
расположенная вблизи его «выходного»
зрачка, на которую нанесен слой
копоти или меди, поглощающий не менее
10% света. Благодаря этому фон поля
зрения приобретает коричневый цвет,
микроскопируемые объекты имеют различные
оттенки — от белого до золотисто-коричневого.
Ход лучей света изображен на рис. 6.
Аноптральный микроскоп применяют
для исследования живых малоконтрастных
объектов: простейших, трепонем и
некоторых вирусов.
Аноптральный метод микроскопии, по сравнению с фазовоконтрастным, дает большую разрешающую способность, глубину резкости и стереоскопичность изображения объекта. Кроме того, значительно устраняется ореол вокруг исследуемого объекта.
Люминесцентная микроскопия. Явление люминесценции (лат. — lumen свет) — холодное свечение вещества заключается в превращении энергии, поглощаемой веществом, в видимое излучение. Свечение вещества происходит под влиянием различных факторов и в зависимости от них различают несколько видов люминесценции. Люминесцентная микроскопия отличается от обычной тем, что объект рассматривается в излучаемом им свете во время облучения его ультрафиолетовыми лучами — первичная флюоресценция. Можно вызвать искусственно вторичную флюоресценцию путем специальной обработки препаратов флюорохромами (акридин, аурамин, нейтральный красный, трипафлавин, корифосфин НК и др.). Флюорохромы способны светиться под влиянием ультрафиолетового, невидимого для глаза, излучения или под влиянием коротковолновых синих лучей видимой части спектра.
Объективы для наблюдения Методом фазовых койтрастой имеют фазовое темное кольцо. Оно нанесено на внутреннюю поверхность одной из склеенных линз, расположенной вблизи выходного зрачка объектива. Фазовое кольцо, слегка поглощая свет, вызывает смещение фазы, соответствующее четверти длины волны.
Фазовоконтрастный конденсор отличается от обычного тем, что в его фокальной плоскости помещены кольцевые
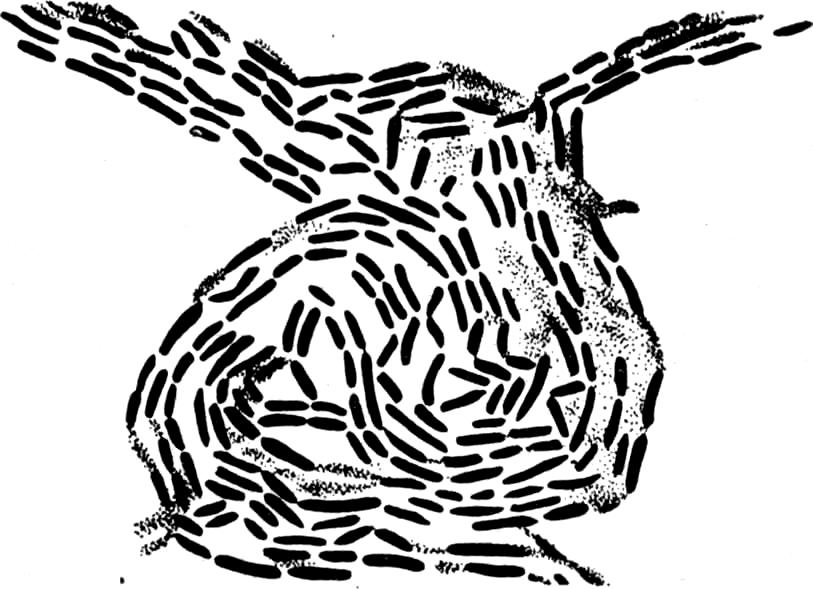
Рис. 5. Изображение в фазовоконтрастном микроскопе живой культуры сенной бациллы на мясо-пептонном агаре.
диафрагмы. Кроме того, имеется револьвер для смены диафрагмы (при смене объектива соответственно меняется и диафрагма). Под револьверным диском находится ирисовая диафрагма и два винта. Конденсор вставляют в конденсо-держатель микроскопа М-9 или МБИ-1.
Вспомогательный микроскоп вставляют в тубус микроскопа вместо окуляра, с помощью которого наблюдают за центрированием кольцевой диафрагмы конденсора по отношению к фазовому кольцу объектива. По окончании центрировки вспомогательный микроскоп заменяют окуляром.
Существенным недостатком фазовоконтрастной микроскопии является слабая контрастность получаемых изображений, наличие ореолов вокруг объектов. В этом отношении аноптральный микроскоп (см. ниже) по сравнению с фазо-воконтрастным устройством обладает значительным преимуществом.
13
Техника флюорохромирования препаратов и
и к р о с к о п и и. Разные виды микроорганизмов обрабатывают раз-ичными флюорохромами: туберкулезные микобактерии — аурамином, ^нококки — акридином желт*ым, дифтерийные коринебактерии — кори-осфином НК и т. д. Для флюорохромирования, например, дифтерийных аринебактерий мазок фиксируют в течение 20 секунд в метиловом спир-3} промывают водой, обрабатывают в течение 10 минут в специальной смеси, состоящей из 5 мл водного раствора корифосфина I : 1000, 10 мл укс!усной киглоты, 85 мл дистиллированной воды, промывают водой, высушивают. Дифтерийные коринебактерии в таком мазке флюоресцируют темно-зеленым цветом, зерна волютина — кирпично-красным, ложнодиф-терийные коринебактерии — бледно-желтым.
Для микроскопии флюорохромированных препаратов в ультрафиолетовом свете необходимы: микроскоп, система фильтров, задерживающих лучи с длиной волны больше ультрафиолетовых, и осветитель ОИ с ртутно-кварцевой лампой СВД-120А. Микроскопия производится в затемненной комнате.
Микроскопия в видимом свете основана на флюоресценции некоторых веществ под влиянием коротковолновых видимых синих лучей. Этот метод более прост и доступен. Недостатком этого метода по сравнению с микроскопией в ультрафиолетовом свете является отсутствие синих и фиолетовых цветов флюоресценции.
Микроскопию производят обычным микроскопом, в качестве источника света используют осветители ОИ-7 или ОИ-9.
Для получения сине-фиолетовой части спектра с определенной длиной волн применяют стеклянные или жидкие светофильтры в комбинации с фильтром, поглощающим красную часть спектра. Излишние синие лучи устраняют светофильтром, находящимся на окуляре.
Преимущества метода флюоресцентной микроскопии по сравнению с обычными методами следующие: цветное изображение, значительная контрастность, возможность исследования морфологии убитых и живых микробов во взвесях из питательных сред, в клетках и тканях инфицированного животного в иммунологических реакциях, а также с целью обнаружения бактерий в небольших концентрациях.
Электронная микроскопия. В электронном микроскопе (рис. 7) вместо света используется поток электронов в безвоздушной среде, на пути которых находится анод. Источником электронов является вольфрамовая проволока, нагреваемая электрическим током (электронная пушка). Оптические линзы заменены электромагнитами. Между вольфрамовой нитью и анодом возникает электрическое поле в 30 000—50 000 W, что сообщает электронам большую скорость и они, проходя через отверстие анода, попадают в первую электромагнитную линзу (конденсор). Электрон-
14
ные лучи по выходе из конденсора собираются в плоскости исследуемого объекта. Они отклоняются под разными углами за счет различной толщины и плотности препарата м попадают в объективную электромагнитную линзу, снабженную диафрагмой. Электроны, мало отклонившиеся при встрече с объектом, проходят через диафрагму, электроны,
2. Освоение методики микроскопии иммерсионным объектом окрашенных препаратов.
~. Демонстрация методов фазовоконтрастной и люминес' тной микроскопии.
 отклонившиеся
под большим углом, задерживаются,
благодаря чему обеспечивается
контрастность изображения. Объективная
линза дает промежуточное увеличенное
изображение, которое наблюдают через
смотровое окно. Новейшие электронные
микроскопы дают увеличение в 5 млн. раз.
отклонившиеся
под большим углом, задерживаются,
благодаря чему обеспечивается
контрастность изображения. Объективная
линза дает промежуточное увеличенное
изображение, которое наблюдают через
смотровое окно. Новейшие электронные
микроскопы дают увеличение в 5 млн. раз.
Электронную микроскопию используют в микробиологии для изучения деталей строения микробной клетки и вирусов.
