
- •Издание второе, переработанное и дополненное
- •Пяткин Кирилл Дмитриевич, Маркова Надежда Степановна, Трофимова Нина Дмитриевна Руководство к практическим занятиям по медицинской микробиологии
- •Издательство «Медицинаэ Москва, ПетроверигскиЯ пер., 6/8 Заказ 7. 11-я типография Главполиграфпрома Комитета по печати при Совете Министров ссср. Москва, Нагатинская ул., д. 1. Цена 72 коп.
- •Микробиологическая лаборатория и ее оборудование. Принципы устройства микроскопов и правила микроскопии Микробиологическая лаборатория и ее оборудование
- •Принципы устройства микроскопов и правила микроскопии
- •Задания
- •Методика приготовления препаратов (мазков) и простые способы окраски. Морфология и строение бактерий (изучение основных форм)
- •2 Заказ ш 7
- •Феноловый фуксин Циля
- •Фуксин Пфейффера
- •Метиленовый синий (тиазин-тетраметил-тионин)
- •Задания
- •Задания
- •Способ Нейссера
- •Морфология и строение актиномицетов и спирохет Морфология и строение актиномицетов
- •Морфология и строение спирохет
- •Задания
- •Морфология и строение вирусов
- •Задания
- •Морфология и строение грибов
- •Задания
- •Морфология и строение простейших
- •Задания
- •Методы стерилизации
- •Культивирование микроорганизмов. Методы посева и выделения чистых культур аэробных бактерий
- •Методы посева чистых культур аэробных бактерий
- •Выделение чистых культур аэробных бактерий
- •Задания
- •Методы выделения чистых культур аэробных бактерий (продолжение). Культивирование и выделение чистой культуры анаэробных бактерий
- •Выделение чистых культур аэробных и анаэробных бактерий (продолжение). Изучение ферментативных свойств бактерий
- •Методы культивирования и выделения риккетсии
- •Методы культивирования и выделения вирусов
- •Задания
- •Действие физических и химических факторов а микроорганизмы. Санитарно-бактериологическое исследование почвы, воды и воздуха
- •Санитарно-бактериологическое исследование почвы, воды и воздуха
- •3 Адания
- •Микрофлора тела человека
- •Действие биологических факторов на микроорганизмы
- •Задания
- •Методические указания о правилах взятия некоторых материалов для микробиологического исследования
- •Задания
- •Задания
- •Задания
- •Задания
- •Получение диагностических сывороток
- •Взаимодействие токсина с антитоксином
- •Реакция преципитации
- •Задания
- •Реакции агглютинации
- •Реакция лизиса и гемолиза
- •Задания
- •Реакция связывания комплемента
- •Реакция фагоцитоза
- •Приготовление и применение вакцин
- •Задания
- •Получение и применение лечебных сывороток
- •Аллергические пробы
- •Лабораторная диагностика стафилококковых и стрептококковых инфекций Лабораторная диагностика стафилококковых болезней
- •Лабораторная диагностика стрептококковых болезней
- •Лабораторная диагностика инфекций, вызываемых пневмококками
- •Задания
- •Лабораторная диагностика эпидемического менингита, гонореи и бленнореи Лабораторная диагностика эпидемического менингита
- •Лабораторная диагностика гонореи и бленнореи
- •Лабораторная диагностика туляремии
- •Лабораторная диагностика бруцеллеза
- •Лабораторная диагностика инфекций, вызываемых escherichia coli. Лабораторная диагностика брюшного тифа, паратифов а и в
- •Задания
- •Лабораторная диагностика холеры
- •Задания
- •Задания
- •Лабораторная диагностика сибирской язвы
- •Задания
- •Задания
- •Свойства дифтерийных и непатогенных коринебактерий
- •Задания
- •Лабораторная диагностика туберкулеза
- •Задания
- •Лабораторная диагностика актиномикоза и трепанематозов Лабораторная диагностика актиномикоза
- •Лабораторная диагностика сифилиса
- •Лабораторная диагностика лептоспирозов
- •Задания
- •Лабораторная диагностика болезней, вызываемых риккетсиями
- •Задания
- •Лабораторная диагностика вирусных инфекций
- •Задания
- •Лабораторная диагностика полиомиелита
- •Лабораторная диагностика Коксаки и echo
- •19 Заказ № 7
- •Задания
- •Задания
- •Лабораторная диагностика дерматомикозов
- •Задания
- •Лабораторная диагностика инфекций, вызываемых простейшими
- •Лабораторная диагностика малярии
- •Лабораторная диагностика лейшманиозов
- •Лабораторная диагностика токсоплазмоза
- •Лабораторная диагностика амебиаза
- •Задания
- •Физиология микроорганизмов
Методы культивирования и выделения риккетсии
Риккетсии являются внутриклеточными паразитами, они выращиваются в искусственных средах, содержащих переживающие ткани (метод Мейтлендов и Цинссера), или в пе-
84
В настоящее время широко применяют культуры перевиваемых тканей различного происхождения (см. Культивирование вирусов).
Риккетсии выращивают при 35—36° в течение 8—14 дней, обильное размножение их наблюдается при пониженном метаболизме.
Риккетсии хорошо размножаются в курином эмбрионе при заражении в полость желточного мешка (метод Кокса). Эмбрионы помещают в термостат при температуре 35—36° па 6—8 дней.
Культивируют риккетсии также в кишечнике платяных вшей по методу Вейгля, им вводят взвесь риккетсии стеклянным капилляром в кишку через анальное отверстие. По методу Пшеничнова и Райхера риккетсии выращивают на личинках вшей, которых кормят дефибринированной кровью через мембрану кожи трупа. В качестве эпидермомембраны используют кожу цыпленка.
Методы культивирования и выделения вирусов
Для культивирования и выделения вирусов служат куриные эмбрионы, культура ткани, чувствительная к данному вирусу.
Культивирование вирусов в развивающемся курином эмбрионе. Культивирование вирусов в курином эмбрионе широко применяется вирусологами в различных направлениях: для диагностики заболеваний, изучения вирусов, приготовления вакцин и др. Используют обычно 7—15-дневные зародыши белых кур.
Заражение производят на хорионаллантоисную оболочку, в аллантоисную полость (рис. 53), желточный мешок (рис. 54), амниотическую полость, тело зародыша и т. д. в строго асептических условиях в боксах.
85
Яйцо помещают в овоскоп и отмечают границы воздушного мешка, хорионаллантоисной оболочки и место положения эмбриона.
Н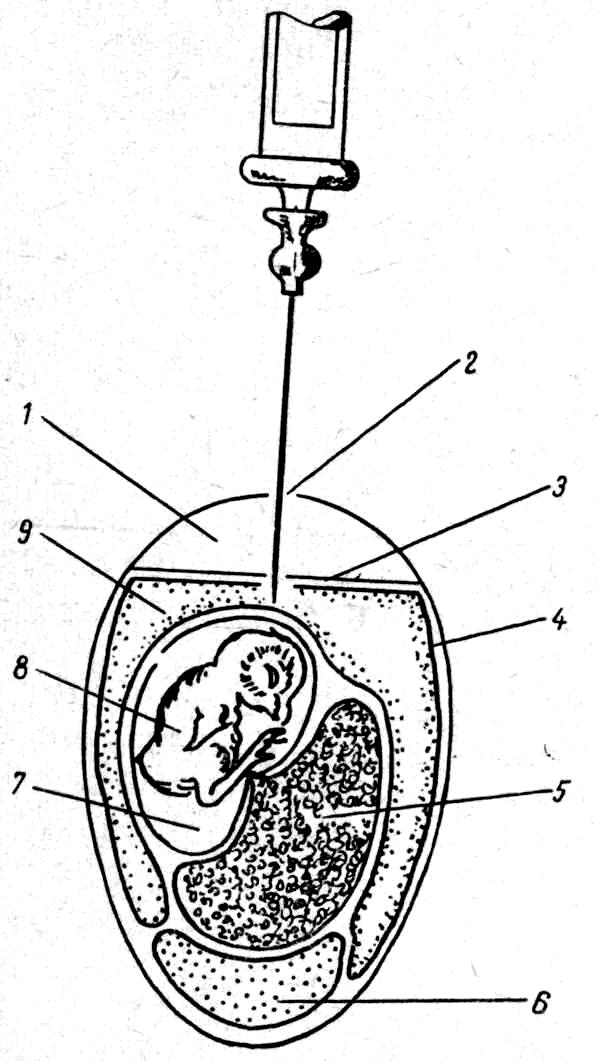 аиболее
распространен способ введения заразного
материала на хорионаллантоисную
оболочку. Скорлупу над воз-
аиболее
распространен способ введения заразного
материала на хорионаллантоисную
оболочку. Скорлупу над воз-

н™ ™' 3аРажение в аллантоис-ную полость куриного эмбриона с™РВ°пЗД^ШНОе пРоетранство; 2-отвер-лочка TP7nnnJ г-ск°Р--'Упная оболочка- 5 „*°Рионал,лантоисная обо-жж 7 *-желт<>чный мешок; 6-белок, 7 _ амнион; 8- плод; S - аллан-тоисная полость.
душным пространством и сбоку над хорионаллантоисной оболочкой дезинфицируют спиртом и йодом, стерильной иглой прокалывают ее над воздушным пространством. Сбоку выпиливают пилкой отверстие в форме тре- или четырехугольника (каждая сторона равна §—6 мм), снимают скорлупу, слегка надрывают нижележащую оболочку, вследствие давления воздуха хорионаллантоисная оболочка запа-
оболочку, вследствие давления воздуха хорионаллантоисная обдает, образуя воздушное пространство. На оболочку шприцем наносят 0,05—0,1 мл материала. При заражении В аллантоисную полость прокалывают хорионаллантоисную оболочку и погружают иглу на 1—2 мм. Отверстие закрывают стерильным покровным стеклом, прикрепляя его полузастывшим парафином.
Более простым способом является заражение в желточный мешок. Яйцо помещают на подставку тупым конусом вправо. Иглой прокалывают скорлупу над воздушным про-етранством, углубляя ее на 3—4 см, попадают в желточный мешок, затем в него вводят инфицированный материал в количестве 0,2—1 мл.
Для введения материала в амниотическую полость скорлупу над воздушным пространством срезают и снимают небольшой участок скорлупной оболочки. Сложенными бран-шами пинцета осуществляют прободение хорионаллантоисной оболочки над эмбрионом. Амниотическую оболочку захватывают пинцетом, выносят ее наружу, производят инъекцию материала и закрывают яйцо крышкой от бюкса.
Слепой способ заражения в амниотическую полость. В овоскопе определяют местоположение эмбриона по его тени на скорлупе. В центре тупого конца яйца делают прокол, через который иглой шприца или пастеровской пипеткой с тонко оттянутым капилляром вносят материал, содержащий вирус. Пипетку вводят резким толчком в направлении тела зародыша. Зараженные эмбрионы выдерживают в термостате при температуре, благоприятной для данного возбудителя.
Время вскрытия зараженных куриных эмбрионов зависит от вида исследуемого вируса.
Вскрытие эмбрионов производят в асептических условиях. Яйца помещают в штатив воздушным мешком кверху. Место вскрытия стерилизуют, так же как перед заражением. Скорлупу над воздушным мешком удаляют ножницами. При вскрытии яиц, зараженных на хорионаллантоисную оболочку, макроскопически изучают наступившие изменения в оболочке и в эмбрионе. Ножницами надрезают хорионаллантоисную оболочку и содержимое яйца выливают в чашку Петри. Оболочку, оставшуюся на внутренней поверхности скорлупы, осторожно отделяют пинцетом, промывают в 0,85% растворе поваренной соли, переносят в сухую чашку и тщательно расправляют.
Размножение вирусов осповакцины и герпеса на хорионаллантоисной оболочке вызывает пролиферативно-некро-
87
86
тические поражения в виде беловатых бляшек. Величина и форма их специфичны для каждого вида вируса. Вирусы накапливаются в большом количестве и образуют характерные оксифильные включения (цитоплазматические при осповак-цине и ядерные при герпесе).
Эмбрионы, зараженные в аллантоисную и амниотическую полости, вскрывают также после обработки скорлупы. Скорлупу и подскорлупную оболочку, прилегающие к отверстию, удаляют, шприцем или пастеровской пипеткой отсасывают вначале аллантоисную, а затем амниотическую жидкость.
Некоторые вирусы вызывают гибель эмбрионов в определенные сроки после заражения.
Независимо от метода заражения для обнаружения вируса применяют реакции гемагглютинации, связывания комплемента и ставят биологические пробы.
Культура тканей для выращивания вирусов. Методы культур тканей применяют в вирусологии более 40 лет (метод Максимова, Карреля, переживающих тканей Мейтлендов и Цинссера и др.). За последние годы подобраны к определенным вирусам весьма чувствительные ткани и разработаны новые методы их культивирования (Эндерс и др.).
Источниками получения тканей являются эмбрионы и взрослые животные. Наиболее часто используют эмбриональные ткани кур, мышей и человека, также успешно применяют эмбрионы свиней и коров.
Из зрелых тканей наибольшее распространение приобрели амнион человека и почки обезьян. Амниотические оболочки человека собирают в родильных домах, соблюдая стерильные условия. Из амниотической оболочки получен перевиваемый штамм клеток FL (Фог, Лунд), он представляет собой быстро растущие эпителиоподобные клетки. Постоянный перевиваемый штамм СОЦ получен из сердечной ткани обезьян циномольгус. Для неперевиваемой культуры из зрелых тканей используют измельченные почки обезьян макаки резус, свободных от латентных вирусов, в частности SV40.
Культура из измельченных зрелых тканей (метод Мейтлендов). Этот метод в современной модификации применяли для выращивания вируса полиомиелита с целью изготовления инактивированной вакцины Солка. Свежие почки обезьян освобождают от капсулы, удаляют почечные лоханки и оставляют наружную часть почечной паренхимы. Ткань измельчают ножницами в среде № 199 (см. ниже) и переносят в матрасы емкостью 1 л с не-
88
большим количеством этой среды. Матрасы встряхивают в специальной качалке (20 покачиваний в минуту). Через сутки ткань заражают вирусом, после 4—7 дней материал обрабатывают для производства вакцины.
Получение первично трипсинизированных однослойных культур. Для этой цели используют эмбрионы человека (10—12-недельный срок беременности), кур, почки обезьян, кроликов и др.
Наиболее широкое применение имеют почки обезьяны, их обрабатывают так же, как описано выше. Измельченную ткань многократно промывают раствором Хенкса и заливают 0,25% раствором трипсина. Во флаконы опускают магнит и размешивают ткань на электромагнитной мешалке при 32° 10 минут. Первую порцию трипсинизированных клеток удаляют, прибавляют раствор трипсина и размешивают 15—20 минут. Вторую и третью порции трипсинизированных клеток сливают и сохраняют при 4°. Последние две порции клеток центрифугируют при 2000 об/мин в течение 30 минут, после чего дважды отмывают раствором Хенкса, осадок разводят синтетической средой № 199, чтобы получить взвесь, содержащую 10 000—40 000 клеток в 1 мл. Подсчет их производят в гемометрической камере Горяева. К взвеси клеток добавляют пенициллин и стрептомицин по 100 ЕД/мл, разливают взвесь клеток по 1 мл в пенициллиновые флаконы или пробирки и помещают в термостат на 4—5 дней. Культуры трипсинизированных тканей сохраняют до 20 дней, при смене питательной среды каждые 4—5 дней, как правило, они не перевиваются.
Перевиваемые культуры опухолевых клеток широко используются во всех вирусологических лабораториях мира: HeLa (клетки фиброкарциномы шейки матки умершей женщины по имени Helen L.), Нер-2 (выделены от больного раком гортани), KB (получены от больного раком языка), Детройт 6 и др.
Растут эти клетки в виде однослойных культур, вирусологические лаборатории получают их из Московского научно-исследовательского института вирусных препаратов. Стабильные штаммы клеток (HeLa, Нер-2, Детройт 6 и др.) перевивают каждые 4—7 дней, для чего их необходимо суспендировать, отделяя от стенок флакона.
Применяют различные методы отделения слоя тканей от поверхности стекла: 1) встряхивание, соскабливание со стекла; 2) действие протеолитическими энзимами или поверхностно-активными веществами.
89
Штаммы клеток, Неплотно прикрепляющиеся к стенкам флаконов, переходят в суспензию при легком встряхивании питательной среды. При более плотном прикреплении клетки отделяют от стекла кусочком резины на стеклянной палочке. Снятые хлопья обычно суспендируют пипеткой.
Из химических веществ наиболее широкое применение приобрел трипсин. При трипсинизации однослойной ткани питательную среду удаляют из флакона и заменяют 0,25% раствором трипсина. Флакон в течение 10 минут несколько раз осторожно встряхивают, полученную суспензию центрифугируют при 1000 об/мин. Трипсин удаляют и заменяют питательной средой.
К числу поверхностно-активных веществ относится версен (диаминоэтантетрауксусная кислота), применяют его в виде растворимой двунатриевой соли в концентрации 1 : 5000 в буферном солевом растворе при рН 7,4. Ткань во флаконе после удаления питательной среды промывают солевым раствором и затем прибавляют подогретый до 37° версен. Флаконы ставят в термостат на 10—15 минут и встряхивают содержимое, чтобы суспендировать клетки. Затем суспензию центрифугируют и надосадочную жидкость заменяют питательной средой.
Решающее значение для успешного культивирования различных тканей имеют питательные среды, которые делятся на естественные и синтетические.
В естественные питательные среды входят изотонические солевые растворы, сыворотки животных и эмбриональные экстракты. Солевые растворы создают необходимую буферность и участвуют в обмене веществ ткани. Некоторые из них содержат индикатор феноловый красный, соду и углекислоту *.
Для приготовления широко применяемого солевого раствора Хепк-са основного берут: NaCl 80 г, KG 4 г, MgS04 • 7Н20 2 г, СаС12 1,4 г, КН2НР04 0,6 г, Na2HP04 • 2Н20 0,6 г, глюкозы 10 г, фенолового красного 0,02 г, воды бидистиллированной до 1 л.
Основной раствор хранят в холодильнике и перед употреблением его разводят в 10 раз дистиллированной водой. Разведенный раствор разливают по 10 мл в пенициллинсзые флаконы, которые закрывают ватными пробками и стерилизуют текучим паром. Затем в каждый из них наливают по 0,25 мл 0,25% раствора ЫаНСОз, закрывают резиновыми пробками и помещают в холодильник на 2—3 дня для растворения углекислоты.
Сыворотки служат источником белкового питания. В зависимости от характера культивируемой ткани применяют сыворотки человека, лоша-
1 Феноловый красный облегчает учет реакции среды. Сода и углекислота являются буферами.
90
материала, обработанного антибиотиками. После 20—30 минут контакта с тканью материал отсасывают пипеткой, наливают питательную среду и флаконы помещают в термостат. Ткань просматривают, пользуясь малым увеличением микроскопа, каждые 3—5 дней для выявления цитопатического действия — изменений в ткани, вызванных вирусами. Некоторые из них (вирусы полиомиелита и Коксаки группы В) разрушают чувствительные штаммы эпителиальных клеток и типа фибробластов, другие вызывают гибель части клеток (вирусы энцефалита).
Ряд вирусов не вызывает изменений культуры ткани и оказывает очень слабое действие (возбудитель гриппа), в последнем случае применяют реакцию гемадсорбции и гем-агглютинации (см. стр. 154, 155).
Титрование вируса в культуре ткани производят методом подсчета бляшек. Последовательно разведенную суспензию вируса наносят на однослойную культуру ткани в 100-граммовых матрасах, трижды отмытую фосфатнобуферным солевым раствором. Матрасы ставят в термостат на один час для адсорбции вируса. При постановке опыта в чашках Петри их помещают в термостат с подачей С02. Затем однослойную культуру ткани быстро покрывают смесью, содержащей равные объемы 20% лошадиной сыворотки, разведенной солевым раствором с 0,04% индикатора нейтрального красного и 3% расплавленного агара, также приготовленного на солевом растворе.
После застывания агара матрасы переворачивают и помещают в термостат при 37°. Результат учитывают ежедневно при боковом освещении на белой или светло-зеленой поверхности. При изучении вируса полиомиелита уже через 48—96 часов инкубации в слое на розовом фоне наблюдаются неокрашенные бляшки диаметром 1—3 мм, образовавшиеся за счет цитопатического действия вируса. Считают, что каждая особь вируса может образовать одну бляшку.
