
- •Міністерство аграрної політики та продовольства України
- •З навчальної дисципліни
- •Для студентів спеціальності
- •5.04010602 - “Прикладна екологія”
- •Лекція 1 Основні поняття і закони хімії
- •Атомно - молекулярне вчення
- •Основні стехіометричні закони хімії
- •Закони газового стану
- •Лекція 2 Будова речовин. Систематика хімічних елементів. Періодичний закон хімічних елементів
- •Будова атома
- •Лекція 3 Хімічний зв'язок. Типи взаємодії молекул
- •Основні положення мвз
- •Механізми утворення хімічного зв'язку
- •Донорно-акцепторний механізм
- •Спрямованість зв'язків та гібридизація атомних орбіталей.
- •Гібридизація атомних орбіталей
- •Лекція 4 Енергетика хімічних процесів
- •Параметри і функції термодинамічного стану
- •Внутрішня енергія
- •Ентальпія
- •Закон гесса
- •Розрахунок теплових ефектів
- •Наприклад, отримання при 25 ºС Al2(sо4)3 з кристалічного Аl2о3 (т) і ґазу sо3 за реакцією:
- •Для н2о, як кінцевого продукту реакції згоряння, приймають .
- •Ентропія
- •Для необоротніх процесів
- •Лекція 5 Хімічна кінетика і хімічна рівновага.
- •Швіидкість хімічних реакцій
- •Залежність швидкості реакції від концентрації реагуючих речовин - закон діючих мас
- •Вплив температури на швидкість реакцій. Енергія активації
- •Каталіз
- •Хімічна рівновага
- •Лекція 6 Розчини. Характеристика розчинів та способи вираження їхнього складу
- •Поняття про розчини
- •Розчинність
- •Способи вираження концентрації розчинів
- •Перший закон Рауля
- •Другий закон Рауля
- •Осмотичний тиск
- •Лекція 7 Розчини електролітів
- •Сильні та слабкі електроліти
- •Дисоціація води
- •Лекція 8 Окисно-відновні реакції
- •Зміна окисно-відновних властивостей елементів в залежності від будови їх атомів
- •Найважливіші окисники та відновники
- •Типи окисно-відновних реакцій. Окислювально-відновний еквівалент
- •Методика складання окисно-відновних реакцій на основі електронного балансу
- •Лекція 9 Загальні властивості металів
- •Елементи-метали в періодичній системі
- •Фізичні властивості металів
- •Хімічні властивості металів
- •Знаходження в природі
- •Лекція 10 Основи електрохімії
- •Лекція 11 Корозія металів. Методи захисту від корозії
- •Захист металів від корозії
- •Лекція 12 Неметали
- •Хімічні властивості неметалів
- •Поширеність, добування і кругообіг неметалів у природі
- •Література
Знаходження в природі
Поширеність елементів-металів у природі різна. Так, вміст в земній корі Al – 7,5 %; Fe – 4,25 %; Ca – 3,25 %. Тобто поширеними є метали з порівняно малими атомними масами. Близько 40 металів не тільки мало поширені (рідкісні), але й розсіяні в земній корі.
В чистому (самородному) вигляді зустрічаються тільки неактивні, головним чином благородні (Au, Ag,Pt, зрідка Hg, Cu).Більшість металів у природі знаходиться у вигляді малорозчинних у воді і стійких до дії повітря сполук, які називають мінералами. Метали в природі найчастіше знаходяться в вигляді оксидів, сульфідів, сульфатів, хлоридів, карбонатів, фосфатів, нітратів та більш складних сполук. Накопичення металовмісних мінералів, що входять до складу гірських порід, з яких технологічно можливо й економічно доцільно вилучати метал, називають рудами. Такі сполуки, як правило, співіснують з великою кількістю інших мінералів, що не містять цей метал (пустою породою).
Руди є основною сировиною металургії – галузі промисловості, що виробляє метал. Для одержання металів використовують руди, що містять метал у достатній кількості у вигляді сполук, доступних для хімічних перетворень. Промислове одержання металів з руд називають металургією. Суттєвою частиною металургії є вивільнення сполук металів від пустої породи. Така операція має назву збагачення. Найефективнішим методом збагачення руд є флотація. Процес флотації оснований на різній змочуваності водою часточок пустої породи і корисного мінералу. Флотаційний процес проводять з використанням так званих флотаційних реагентів. Це спеціальні за складом речовини, які вибірково адсорбуються на поверхні часточок корисного мінералу і не адсорбуються на часточках пустої породи. Внаслідок адсорбції флотаційних реагентів часточки корисного мінералу набувають здатності не змочуватися водою.
Для проведення флотації подрібнену руду вміщують у посудину з водою, в якій розчиняють флотаційні реагенти, і крізь розчин пропускають повітря. Бульбашки прикріплюються до часточок мінералу, що не змочуються водою, і піднімають їх на поверхню розчину. Часточки ж пустої породи, що добре змочуються, не прилипають до бульбашок повітря і осідають на дно посудини. Збагачену руду збирають з поверхні розчину.
Руди, що містять мінерали, які мають магнітні властивості (Fe3O4), збагачують методом магнітної сепарації. Магнітний сепаратор – це барабан з електромагнітами, на який за допомогою конвеєра подається подрібнена руда. Пуста порода, що не має магнітних властивостей, проходить через магнітне поле і вільно падає з барабана. Зерна руди, що містять магнітні мінерали заліза намагнічуються і, затримуючись на барабані, відокремлюються пізніше, ніж пуста порода. Для більш ретельного відокремлення пустої породи магнітну сепарацію руди повторюють кілька разів.
Лекція 10 Основи електрохімії
План
Поняття та визначення. Електродний потенціал
Хімічні джерела електричної енергії
Гальванічні елементи
Акумулятори
Паливні елементи
Електроліз
Електрохімія – розділ хімії, в якому вивчають закономірності взаємного перетворення електричної та хімічної енергії. Подібні перетворення здійснюються в електрохімічних системах, складовими системами яких є:
1) електроліт, який забезпечує проходження електричного струму (провідник другого роду) й містить речовини, здатні окиснюватися або відновлюватись на електродах;
2) електроди, що забезпечують контакт з електролітом та обмін електронами з учасниками реакції;
3) зовнішній ланцюг (провідник першого роду) – металічний провідник, який сполучає електроди.
Електрохімічні реакції є окисно-відновними гетерогенними реакціями, які перебігають на електродах, тобто на межі поділу двох фаз.
При зануренні металічної пластинки у воду під впливом її полярних молекул катіони металу переходять до рідкої фази. На межі „метал – розчин” швидко встановлюється рухома окисно-відновна рівновага:
Ме + nH2O
⇄
Me(H2O)![]() + n
+ n![]()
або спрощено
Ме ⇄
Me![]() + n
.
+ n
.
На поверхні металічної пластинки виникає подвійний електричний шар. Різницю потенціалів, яка виникає між металом та водним середовищем у стані рівноваги, називають рівноважним електродним потенціалом або потенціалом електрода.
При зануренні металу у розчин його солі також виникає подвійний електричний шар, але в цьому випадку можливі два механізми його утворення. Якщо концентрація катіонів металу в розчині не досягає рівноважної або метал досить активний, то рівновага процесу окиснення металу зміщується праворуч, металічна пластинка заряджується негативно. Якщо концентрація катіонів металу в розчині перевищує рівноважну або метал малоактивний, то рівновага зміщується ліворуч, металічна пластинка заряджуєтьмя позитивно.
Різниця
потенціалів, яка виникає між металом
та розчином є електродним потенціалом – .
Потенціал металу в розчині його солі
записують як
![]() (
(![]() – окиснена
форма металу,
– окиснена
форма металу,
![]() – відновлена
форма металу, риска – поверхня
розділу „розчин-метал”). Потенціалу
приписують той знак, який виникає на
металі в подвійному електричному шарі.
– відновлена
форма металу, риска – поверхня
розділу „розчин-метал”). Потенціалу
приписують той знак, який виникає на
металі в подвійному електричному шарі.
Величина електродного потенціалу для металічних електродів залежить від природи металу, концентрації його йонів у розчині електроліту та температури і обчислюється за рівнянням Нернста:
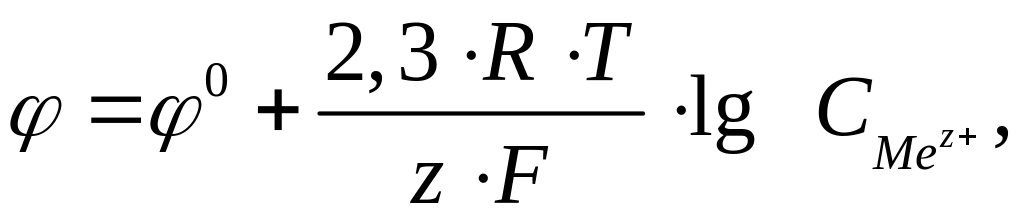
де
0 – стандартний
електродний потенціал (потенціал, який
виміряно за стандартних умов:
![]() =
1 моль/л, р
= 101,325 кПа, Т =
298 К); R = 8,314 Дж/(К·моль); T
– абсолютна температура, К; z – заряд
йону металу; F
= 96500 Кл/моль, стала Фарадея;
–
концентрація йонів металу в розчині,
моль/л.
=
1 моль/л, р
= 101,325 кПа, Т =
298 К); R = 8,314 Дж/(К·моль); T
– абсолютна температура, К; z – заряд
йону металу; F
= 96500 Кл/моль, стала Фарадея;
–
концентрація йонів металу в розчині,
моль/л.
При Т = 298 К рівняння Нернста має вигляд:
 .
.
Абсолютне
значення потенціалу окремого електрода
виміряти неможливо, оскільки він
реалізується в різних фазах. Його
вимірюють відносно величини потенціалу
іншого електрода. Такі електроди
називають електродами порівняння.
Найчастіше для цієї мети використовують
стандартний водневий електрод, для
якого потенціал умовно приймають за
![]() В.
В.
Більшість стандартних електродних потенціалів визначають експериментально. Але для лужних та лужно-земельних металів 0 обчислюють лише теоретично. Це пояснюється тим, що дані метали взаємодіють з водою.
Значення стандартних електродних потенціалів металів, що розміщені у порядку їх зростання утворюють ряд, який називають рядом стандартних електродних потенціалів або електрохімічним рядом напруг (додаток 8). Стандартний електродний потенціал є мірою хімічної активності металу. Положення того чи іншого металу у ряді напруг характеризує відновну здатність металів та окиснювальну здатність їх йонів у водних розчинах. Чим менше алгебраїчна величина потенціалу, тим вище відновна здатність цього металу.
Спеціальні пристрої, в яких на електродах відбуваються cамодовільні окисно-відновні процеси і які створюють різницю потенціалів, а отже можливість напрямленого переміщення електронів від одного електрода (негативного) до другого (позитивного), тобто електричний струм, називають хімічними джерелами струму (ХДС). При цьому хімічна енергія окисно-відновної реакції перетворюється на електричну. До таких пристроїв відносять гальванічні та паливні елементи, акумулятори.
Гальванічний елемент складається із двох електродів – анода і катода, занурених у розчин або розплав електроліту, електролітичного ключа (сольовий місток) і зовнішньої схеми (металічні провідники та вимірювач напруги чи сили струму).
У гальванічних елементах окисно-відновні реакції протікають на поверхні електродів. Процеси окиснення і відновлення просторово розділені. Окиснення протікає на аноді, відновлення – на катоді. У гальванічному елементі анодом є електрод, потенціал якого менший, ніж потенціал катода. Анод має заряд "–", катод – заряд "+".
Максимальну напругу гальванічного елемента, яка відповідає оборотному процесу окисно – відновної реакції на його електродах, називають електрорушійною силою – Е (ЕРС) елемента. Якщо реакція здійснюється за стандартних умов, тобто якщо всі речовини, які беруть участь у реакції, перебувають у своїх стандартних станах, то ЕРС, що досягається називають стандартною ЕРС цього елемента. ЕРС гальванічного елементу обчислюють як різницю між потенціалами катода к і анода а.: Е = к – а.
Прикладом гальванічного елемента є мідно-цинковий елемент Даніеля-Якобі, що складається з цинкової та мідної пластинок, занурених в розчини сульфатів цинку та купруму (ІІ) з молярними концентраціями 1 моль/л (рис. 1).
Цинковий
електрод є анодом, на якому проходить
реакція окиснення: Zn![]() = Zn2+
+ 2ē.
= Zn2+
+ 2ē.
Мідний електрод – катод, на якому проходить відновлення йонів міді з розчину: Cu2+ + 2ē = Cuo
Сумарне рівняння процесу в йонному вигляді:
Zn + Cu2+ = Cuo + Zn2+,
або в молекулярній формі: Zn + CuSO4 = Cu + ZnSO4.
Схематичний запис гальванічного елемента:
(–) Zn ZnSO4 CuSO4 Cu (+).
За стандартних умов ЕРС гальванічного елемента (додаток 1):
![]() .
.

Рис. 1. Схема гальванічного елемента Даніеля-Якобі
Поляризація – це зміна величини електродного потенціалу катода чи анода через зміну стану поверхні електрода – утворення нерозчинних солей, оксидних і газових плівок, які виникають на поверхні електрода при роботі гальванічного елемента. Наприклад, для гальванічного елементу: Zn | H2SO4 | Cu на катоді відбувається процес: 2H+ + 2ē → H2↑.
Хімічна поляризація в цьому випадку обумовлена утворенням газової плівки водню, що ізолює поверхню катода від розчину електроліту, в наслідок чого зменшується ЕРС.
Концентраційна поляризація електродів виникає за рахунок зміни концентрації йонів у приповерхневому шарі електрода, що впливає на величину потенціалу електрода. Наприклад, при роботі мідно-цинкового гальванічного елемента:
Zn │ZnSO4 ║СuSO4 │ Cu
зростає концентрація йонів Zn2+ біля анода і зменшується концентрація йонів Сu2+ біля катода, це призводить до зближення потенціалів катода і анода, тобто до зменшення ЕРС. Усунення або зниження поляризації називається деполяризацією. Концентраційна поляризація зменшується за рахунок перемішуванням електроліту, а хімічна – введенням деполяризаторів.
Гальванічні елементи оборотної та багаторазової дії називають акумуляторами. Дані пристрої здатні при розряджанні перетворювати накопичену хімічну енергію на електричну (як гальванічний елемент), а при заряджанні електричну – на хімічну (як електролізер). Найбільше застосування мають свинцевий (кислотний) та лужні акумулятори. Свинцевий акумулятор складається з свинцево-стибієвих перфорованих пластинок. Отвори пластинок заповнюють пастою PbO i 2PbO · PbO2. Електроліт – розчин з масовою часткою сульфатної кислоти 35 %. Розглянемо принцип дії свинцевого акумулятора, схему якого можна записати так:
А (–) Рb|Н2SO4|PbO2 (+) K.

Рис.2. Схема роботи свинцевого акумулятора при заряджанні та розряджанні
Під час заряджання, коли через акумулятор пропускають постійний електричний струм, на електродах відбуваються такі електрохімічні процеси:
На катоді (–): PbSO4 + 2е → Pb + SO42–.
На аноді (+): PbSO4 + 2Н2О → РbО2 + 4Н+ + SO42– + 2е.
Під час розряджання акумулятора на електродах відбуваються протилежні процеси:
На
аноді (–):
Pb + SO![]() →
PbSO4
+
2е;
φ° = 0,36 В.
→
PbSO4
+
2е;
φ° = 0,36 В.
На катоді (+): РЬО2 + 4Н+ + SO + 2е → PbSO4 + 2Н2О; φ°= 1,68 В.
Загальне
рівняння реакції роботи свинцевого
акумулятора має вигляд: Pb + 2H2SO4
+ РbO2
![]() 2PbSO4
+ 2H2O.
2PbSO4
+ 2H2O.
Pb
+ 2H2SO4
+ РbO2
![]() 2PbSO4
+ 2H2O
2PbSO4
+ 2H2O
ЕРС акумулятора E° = φ°к – φ°а = 1,68 – (– 0,36) = 2,04 В.
Різниця потенціалів зарядженого акумулятора дорівнює 2,04 В; якщо вона знижується до 1,7 В, то це свідчить, що акумулятор треба заряджати. Під час експлуатації (роботи, розрядження) акумулятора густина електроліту (розчину Н2SO4) знижується, тоді як під час зарядження його, навпаки, – зростає.
Перевагами свинцевих акумуляторів є: стабільність у роботі, великі електрична ємність, кількість циклів розрядження – зарядження та термін зберігання (до 2 років), а недоліками – великі маса і розміри, отже мала питома ємність, виділення водню під час розрідження та негерметичність у процесі використання агресивного електроліту. Дещо кращими є лужні акумулятори, наприклад нікель-кадмієві, нікель-залізні, срібно-цинкові тощо.
В нікель-залізному акумуляторі отвори залізних пластинок заповнені Ni2O3 H2O (або Ni(OH)3) у суміші з порошком графіту та порошком відновленого заліза. Заряджання й розряджання лужного нікель-залізного акумулятора відбувається за схемою:
Fe + 2Ni(OH)3 Fe(OH)2 + 2Ni(OH)2;
Fe + 2Ni(OH)3 Fe(OH)2 + 2Ni(OH)2.
Напруга цього акумулятора при його розряджанні становить близько 1,3 В.
В паливних елементах електричний струм виникає в результаті хімічної взаємодії горючих речовин з окисниками, які безперервно подаються ззовні до електродів, а продукти реакції безперервно відводяться. Роль активних матеріалів негативного електрода (анода) відіграють звичайні види палива (горючі речовини): водень, бензин, природний газ, карбон(ІІ) оксид, кокс, метанол тощо). Активним матеріалом катода паливного елемента може бути: кисень повітря, або чистий кисень, хлор.
Прикладом може бути воднево-кисневий елемент, який складається з дрібнопористих вугільних або нікелевих електродів, занурених у лужний розчин електроліту:
А (–) (Ni) H2 | KOH |O2 (Ni) (+) K
А: 2Н2 + 4ОН– = 4Н2О + 4 .
К: О2 + 2Н2О + 4 = 4OH– .
Водень дифундує крізь пористий електрод з каталізаторами (Pt, Pd), кисень – крізь другий електрод зі змішаними каталізаторами (Co і Аl або Fe, Mn і Ag). Воднево-кисневі елементи генерують струм 500-700 мА на 1 см2 активної поверхні електродів при напрузі близько 1 В та ККД 60 – 70 %.
Електроліз – сукупність окисно-відновних процесів, що протікають на поверхні електродів при проходженні постійного електричного струму через розплав чи розчин електроліту.
Пристрої, в яких електричний струм від зовнішніх джерел витрачається для здійснення на електродах окисно-відновних реакцій, називають електролізерами, де відбуваються електролізні процеси. Електрод, на якому відбувається процес відновлення, називається катодом, а електрод на якому відбувається процес окиснення – анодом. Механізми процесів відновлення і окиснення залежать від хімічного характеру електроліту, його стану, природи електродів та інших факторів. Тому необхідно розглядати окремо процеси електролізу розплавів і розчинів, а також процеси електролізу з інертним і активним (металевим) анодами.
Інертні аноди виготовляють із платини, іридію або їх сплавів, а також із графіту або вугілля. У процесі електролізу вони не розчиняються.
При електролізі розплавів на катоді відновлюються катіони, а на аноді окиснюються аніони електроліту. Наприклад:
1) Електроліз розплаву натрій хлориду. При проходженні електричного струму крізь розплав натрій хлориду катіони натрію під дією електричного поля пересуваються до негативного електрода (катода), де відбувається їх відновлення. Аніони хлору пересуваються до позитивного електрода (анода), де віддають електрони, тобто окиснюються – це перша стадія. На другій стадії – утворюється молекула хлору з атомів. Схема електролізу має вигляд:
N

 aCl
⇄
Na+
+ Cl–
aCl
⇄
Na+
+ Cl–
(–) Катод Анод (+)
Na+ + ē = Na 2Cl– = 2Cl + 2ē
2Cl = Cl2 .
Сумарне рівняння окисно-відновної реакції, яка проходить при електролізі розплаву натрій хлориду має вигляд: 2Na+ + 2Cl– = 2Na + Cl2.
2) Схема електролізу розплаву кальцій гідроксиду:
С a(ОН)2
⇄
Сa2+
+ 2ОН–
a(ОН)2
⇄
Сa2+
+ 2ОН–
(–) Катод Анод (+)
Сa2+ + 2ē = Сa 4ОН– = 2Н2О + О2 + 4ē.
При електролізі водних розчинів на катоді відбувається відновлення окисників у порядку зменшення їх електродних потенціалів.
При
електролізі водних розчинів потрібно
враховувати величину потенціалу процесу
відновлення йонів Гідрогену. Цей
потенціал залежить від концентрації
йонів Гідрогену, і у випадку нейтральних
розчинів (рН=7)
![]() .
.
Таким чином, на катоді можливі три випадки:
1. Відновлення в першу чергу окисників, у яких електродні потенціали вищі, ніж потенціал водневого електрода. Це катіони Au+, Ag+, Cu2+, платинових металів. Відновлення відбувається за схемою:
Mez+ + zē = Me.
Наприклад при електролізі водного розчину купрум(ІІ) хлориду на катоді відбувається відновлення йонів Cu2+: Cu2+ + 2ē = Cu;
2. Відновлення
катіонів металів, потенціал яких нижчий,
ніж у водневого електрода (починаючи
приблизно від Станума), але виший, ніж
у титанового (метали середньої части
ряду напруг: Zn, Cr, Fe, Cd, Ni). З урахуванням
концентрації розчину і умов електролізу
(густини струму, температури, складу
розчину) можливе одночасне відновлення
з катіонами металів і йонів Гідрогену
(в кислому середовищі): 2Н+
+ 2ē = Н2↑![]()
або відновлення молекул води (в нейтральному і лужному середовищі):
2Н2О + 2ē = Н2↑ + 2ОН–.
Наприклад, при електролізі водного розчину цинк сульфату на катоді відбувається і відновлення йонів Zn2+: Zn2+ + 2ē = Zn;
і відновлення молекул води: 2Н2О + 2ē = Н2↑ + 2ОН–.
3. Відновлення молекул води, якщо водний розчин солей містить катіони металів, у яких потенціали нижчі, ніж у титану:
2Н2О + 2ē = 2ОН– + Н2↑.
Наприклад, при електролізі водного розчину калій сульфату на катоді відбувається відновлення молекул води.
Характер реакцій на аноді залежить від присутності води, pH середовища і матеріалу анода. У водних розчинах електролітів на інертному аноді спочатку окиснюються найбільш сильні відновники, тобто речовини з найменшим електродним потенціалом, наприклад, сульфід-йон, галогенід-йони та ін. Потім у лужному середовищі окиснюються гідроксид-йони:
4ОН–
= О2↑
+ 2Н2О
+ 4ē ![]() =
0,401 В;
=
0,401 В;
у кислому або нейтральному середовищі окиснюються молекули води, якщо в розчині є оксигеновмісні аніони SO42–, NO3–, ClO3–, PO43–:
2H2O = O2↑ + 4H+ + 4ē = 1,228 B.
Послідовність окиснення аніонів і молекул на інертному аноді можна показати у вигляді такого ряду:
S2–, I–, Br–, Cl–, OH–, H2O |
SO |
|
у водних розчинах не окиснюються |
При проведенні електролізу з активним анодом матеріал аноду розчиняється: Me = Mez+ + zē.
Наприклад, при електролізі водного розчину нікол (ІІ) сульфату з нікелевим анодом на катоді відбувається головним чином разряд йонів Ni2+ і виділення металу, а на аноді – окиснення металу (розчинення), так як потенціал ніколу менше потенціалу окиснення води і потенціалу окиснення йону SO .
N і SO4 ⇄ Nі2+ + SO
(–) Катод Анод (+)
Nі2+ + 2ē = Nі Nі = Nі2+ + 2ē.
Цей процес застосовується для електролітичної очистки нікелю (електролітичне рафінування).
Кількісно процеси електролізу визначаються законами Фарадея:
1) маса електроліту, що піддається перетворенню при електролізі, а також маси речовин, що виділяються на електродах, прямо пропорційні кількості електрики, що пройшла через розчин чи розплав електроліту:
![]() ,
,
де
![]() –
електрохімічний еквівалент, що дорівнює
масі речовини, яка виділилася при
протіканні одиниці кількості електрики
(г/Кл);
–
електрохімічний еквівалент, що дорівнює
масі речовини, яка виділилася при
протіканні одиниці кількості електрики
(г/Кл);
2) при пропусканні однакової кількості електричного струму крізь розчини або розплави різних електролітів маси речовин, які виділилися на електродах, пропорційні їх молярним масам еквівалентів:
 .
.
Обидва закони поєднують загальною формулою:
 ,
,
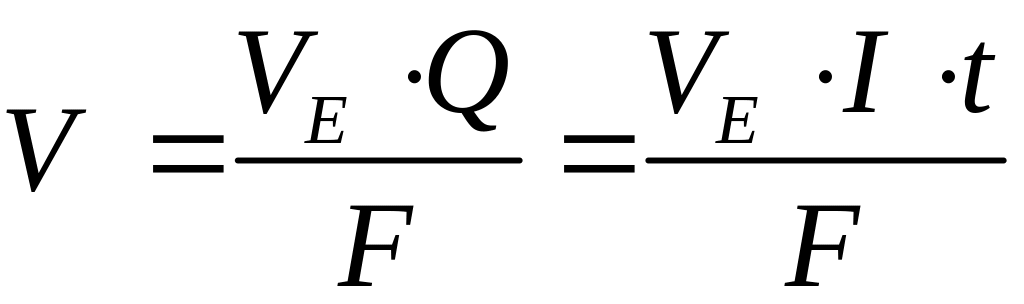 ,
,
де
m, V – маса чи об’єм речовини, що зазнає
перетворення на електродах (виділяється
чи розкладається); ME
– молярна маса еквівалентів речовини,
г/моль;
![]() – об’єм
1 моль еквівалента речовини; I – сила
струму, А; t – час, с; F – стала Фарадея.
– об’єм
1 моль еквівалента речовини; I – сила
струму, А; t – час, с; F – стала Фарадея.
Проведення процесу електролізу завжди викликає виникнення деякої різниці потенціалів, направленої протилежно тій, яка накладається зовні. Це явище одержало назву поляризація. Розрізняють хімічну і концентраційну поляризації.
Хімічна поляризація виникає внаслідок того, що виділення продуктів електролізу призводить до утворення гальванічного елемента. Наприклад, при електролізі розчину сульфатної кислоти водень і кисень, які виділяються відповідно на катоді і аноді, утворюють воднево-кисневий елемент, виникнення якого протидіє електролізу.
Концентраційна поляризація пов’язана з тим, що в процесі електролізу концентрації електроліту в катодному і анодному просторах змінюються і стають різними. Наприклад, при електролізі розчину нікелю з двома нікелевими електродами концентрація розчину в катодному просторі зменшується, а в анодному – збільшується. Виникає концентраційний елемент, ЕРС якого направлена протилежно накладеній різниці потенціалів.
Поляризація електродів збільшує витрату електричної енергії при електролізі, тому її намагаються якомога знизити.
Послабити концентраційну поляризацію можливо шляхом перемішування електроліту або обертанням електродів. Але цілком позбутися концентраційної поляризації не можна, тому що біля електрода завжди є дуже тонкий шар розчину, в якому рідина практично не перемішується. Щоб зменшити концентраційну поляризацію, електроліз проводять в насичених розчинах з надлишком твердої фази.
Для усунення хімічної поляризації необхідно повністю видаляти з електродів продукти електролізу, що призводять до виникнення елемента з протилежною ЕРС. З цією метою використовують хімічні деполяризатори. Так, для деполяризації катода застосовують окисники, які зв’язують водень, що виділяється на катоді (MnO2, K2Cr2O7 та ін.). Для деполяризації анода, навпаки, необхідні відновники, що зв’язують кисень (наприклад, етанол, який окиснюється на аноді до оцтової кислоти).
Мінімальна
різниця потенціалів, яку треба створити,
щоб електроліз відбувся, називається
напругою розкладання Ер,
а різниця між напругою розкладання і
ЕРС (Е) утвореного гальванічного елемента
називається перенапругою
![]() U,
тобто
U,
тобто
U = Ер – Е.
Величина
перенапруги
![]() U
залежить від матеріалу електродів,
концентрації електроліту тощо.
U
залежить від матеріалу електродів,
концентрації електроліту тощо.
Для
врахування частини електрики, що пройшла
через електроліт і витратилась на
добування бажаного продукту введено
поняття вихід за струмом. Вихід
за струмом ŋ
можна визначити як відношення маси
речовини, добутої під час електролізу
(![]() ),
до кількості теоретично обчисленої за
законом Фарадея (
),
до кількості теоретично обчисленої за
законом Фарадея (![]() ):
):
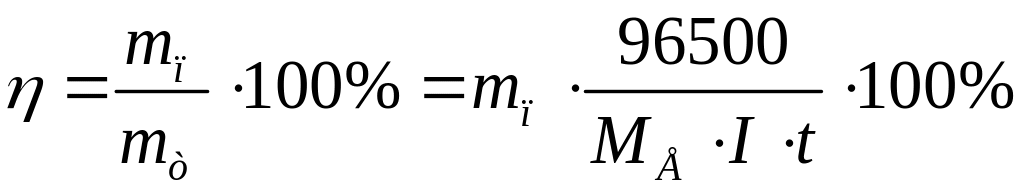 .
.
Або
вихід за струмом визначається як
співвідношення кількості електрики,
необхідної за законом Фарадея для
добування даної кількості речовини
(![]() ),
до кількості електрики, практично
витраченої на добування тієї самої
кількості речовини (
),
до кількості електрики, практично
витраченої на добування тієї самої
кількості речовини (![]() ):
):
 .
.
Електроліз широко застосовується у металургійній та хімічній промисловості. Електролізом розплавів одержують лужні, лужноземельні метали та алюміній. Електролізом водних розчинів солей одержують цинк, кадмій, мідь та деякі інші метали. Електрохімічне рафінування металів використовують для одержання чистих металів (міді, олова, свинцю, срібла). Процеси електроосадження використовують для покриття поверхні одного металу іншим.
Гальваностегія – нанесення металевих покриттів з різною метою: захист від корозії, зміцнення поверхні, декоративне, антифрикційне, відновлення розмірів деталей (реставраційний ремонт), підвищення електропровідності та магнітних характеристик тощо. Найпоширенішими процесами є цинкування, нікелювання, міднення, хромування, кадміювання, лудження (покриття оловом). В гальваностегії катодом є виріб, який вкривають, а анодом – той самий метал, що осаджується на катоді.
Гальванопластика – виготовлення і розмноження копій деталей високої точності, відтворення макро- і мікрогеометричного рельєфу (матриці для грамплатівок, друкарські стереотипи, кліше, валки для тиснення шкір, тканин і фольги, копії з творів мистецтва тощо).
Електрохімічне оброблення металів – метод формоутворення виробів з металів будь-якої міцності й твердості, які важко піддаються механічному обробленню.
