
- •Готовимся к федеральному интернет-экзамену
- •Тобольск
- •Оглавление
- •Введение
- •Форма и структура экзаменационной работы
- •Блок «общая и неорганическая химия» Тема заданий : «Строение атома и периодическая система».
- •Тема заданий : «Химическая связь и строение вещества»
- •Блок «аналитическая химия» Тема заданий: «Теоретические основы аналитической химии»
- •Блок «физическая химия» Тема заданий: «окислительно-восстановительные и электрохимические процессы»
- •Тема заданий: «Химическая кинетика и катализ».
- •Блок «коллоидная химия»
- •Блок «высокомолекулярные соединения» Тема заданий: «Методы получения полимеров»
- •Тема заданий: «Органические и неорганические полимеры»
- •Тема заданий: «Строение и свойства полимеров»
- •Заключение рекомендуемая литература
- •Периодическая система
- •Дисперсные системы
- •Качественные реакции:
- •626150, Г. Тобольск, ул. Знаменского, 58.
Блок «аналитическая химия» Тема заданий: «Теоретические основы аналитической химии»
Раствор, в 1 л которого содержится 0,01 моль HNO3, имеет pH, равный …
Варианты ответов: 1)2; 2)4; 3)11; 4)12
-
Дано:
n= 0,01 моль
VHNO3 =1 л
Решение:
pH = - lg [H+]
[H+] = CHNO3
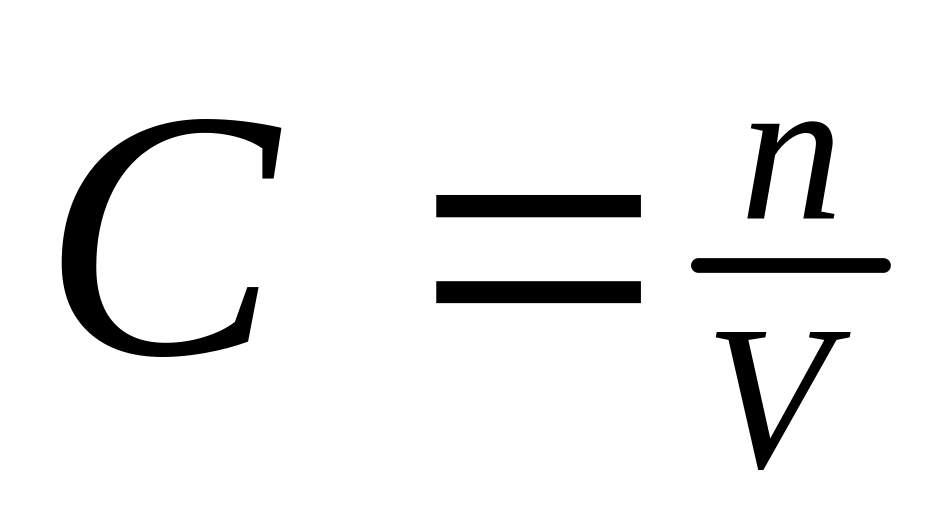 ;
;

pH = - lg 0,01 = 2
Ответ: pH = 2
pH = ?
Раствор, в 1 литре которого содержится 0, 1 моль NaOH, имеет pH, равный …
Варианты ответов: 1)10; 2)13; 3)4; 4)1
-
Дано:
n= 0,1 моль
V NaOH =1 л
Решение:
pH = 14 – p [OH-]
p [OH-] = - lg [OH-]
[OH-] =CNaOH
;
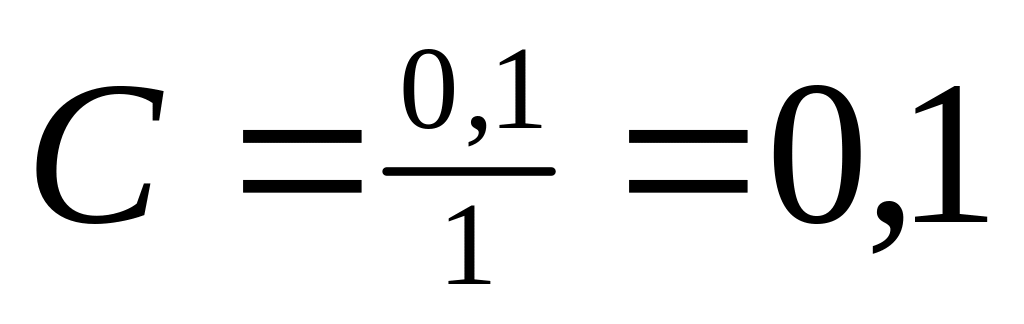
pOH = - lg 0,1 =1
pH = 14 – pH
pH = 14 – p [OH-]
pH = 14 – 1 =13
Ответ: pH = 13
pH = ?
3. Раствор, в котором сохраняется значение pH при добавлении небольших количеств кислоты или основания, называется …
буферным;
амфотерным;
апротонным
протолитическим
4. В 1 л раствора NaOH, имеющего pH=13, содержится _________моль гидроксида.
Варианты ответов: 1)0,13; 2)0,2; 3)0,1; 4)0,26
-
Дано:
pH = 13
V NaOH =1 л
Решение:
pH = 14 – p [OH-]
p[OH-] = 14-13=1
[OH-] =10-1=0,1
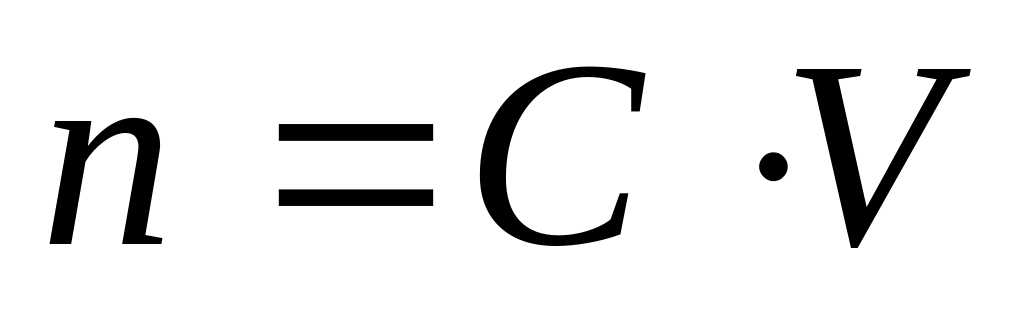
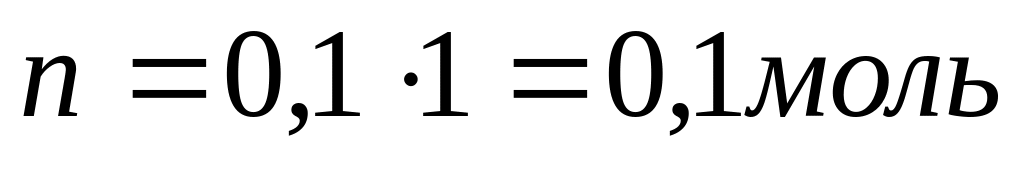
Ответ: n=0,1 моль
n = ?
5. В 2 л раствора HNO3, имеющего pH=2, содержится _________моль HNO3
Варианты ответов: 1)1; 2)0,02; 3)0,01; 4)2
-
Дано:
pH = 2
V HNO3 =2 л
Решение:
[H+ ]=10-2
[H+ ] = CHNO3
10-2 = 0,01
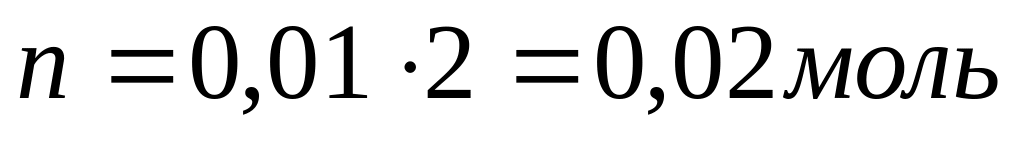
Ответ: n=0,02 моль
n = ?
Вещество, имеющее свою окраску в зависимости от pH среды, называется…
1)электролитом
2)индикатором
3)реагентом
4)красителем
Для приготовления 1 л раствора KOH с pH = 12 необходимо … моль KOH.
2
0,01
1
0,02
-
Дано:
pH = 12
V KOH =1 л
Решение:
p[OH-] = 14 – pH значит:
p [OH-] = 14-12=2
[OH-] =10-2=0,01
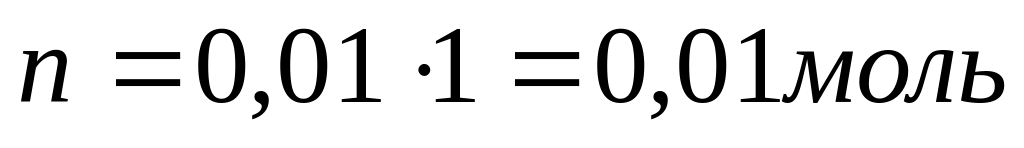
Ответ: n=0,01моль
n = ?
Ионному произведению воды соответствует формула…
[H+]*[OH-] = 10-14
[H+]=[OH-] *10-14
[H+]/[OH-] = 10-14
[H+]*[OH-] = 10-7
Формула соли, водный раствор которой проявляет кислую реакцию, имеет вид…
Na2SO3
NaCl
Na3PO4
FeSO4 (слабое основание, сильная кислота)
10. Для водных растворов справедливо соотношение…
pH < pOH
pH + pOH = 7
pH + pOH =14
pH > pOH
11. Формула соли, водный раствор которой проявляет щелочную реакцию, имеет вид…
1) CuSO4
2) K2CO3
3) KCl
4) Fe(NO3)2
12. Для приготовления 2 л раствора HCl с pH = 1 требуется ____ моль HC.
1) 0,1
2) 2
3) 1
4) 0,2
-
Дано:
pH = 1
V HCl =2 л
Решение:
[H+ ]=10-1
[H+ ] = CHCl
10-1 = 0,1
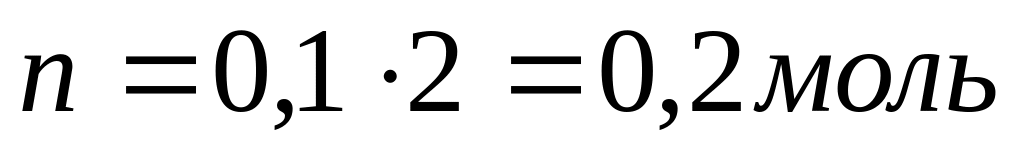
Ответ: n = 0, 2 моль
n = ?
13. При разбавлении 0,2 М раствора HCl в 2 раза, pH будет иметь значение равное…
1) 14
2) 1
3) 3
4) 13
-
Дано:
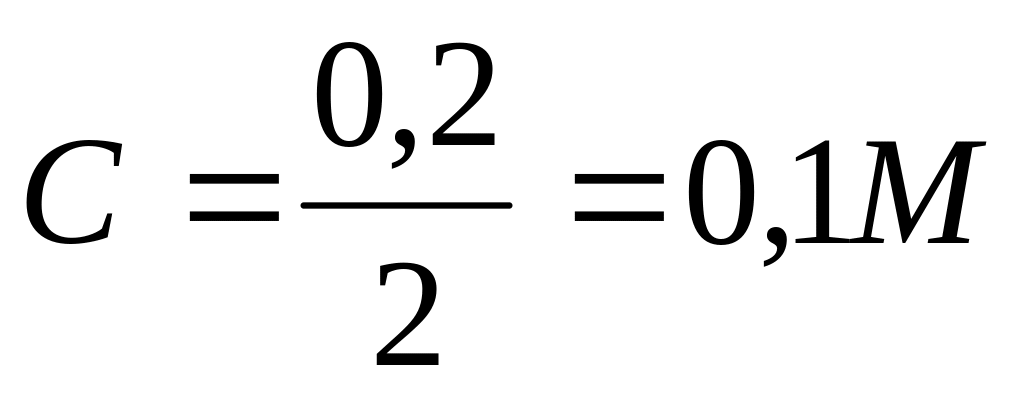
Решение:
pH =- lg[H+ ]
[H+] = C HCl
;
pH =- lg 0,1=1
Ответ: pH =1
pH = ?
14. Для определения pH растворов потенциал (определяющим) метрическим методом наиболее часто используется стеклянный электрод.
1) стеклянный
2) металлический
3) газовый
4) окислительно-восстановительный
15. В 2 л раствора KOH, имеющего pH = 13, содержится _____ моль KOH
1) 0,1
2) 0,2
3) 1
4) 2
-
Дано:
pH = 13
V KOH =2 л
Решение:
p[OH-]=14–pH значит:
p [OH-] = 14-13=1
[OH-] =10-1=0,1
Ответ: n=0,2моль
n = ?
16. Раствор, в 500 мл которого растворено 1,825 г HCl, имеет pH равный..
1) 4
2) 5
3) 2
1) 1
-
Дано:
V=500мл=0,5л
mHCl=1,825г
MHCl=36,5 г/моль
Решение:
pH = - lg [H+ ]
[H+ ] = C HCl
;

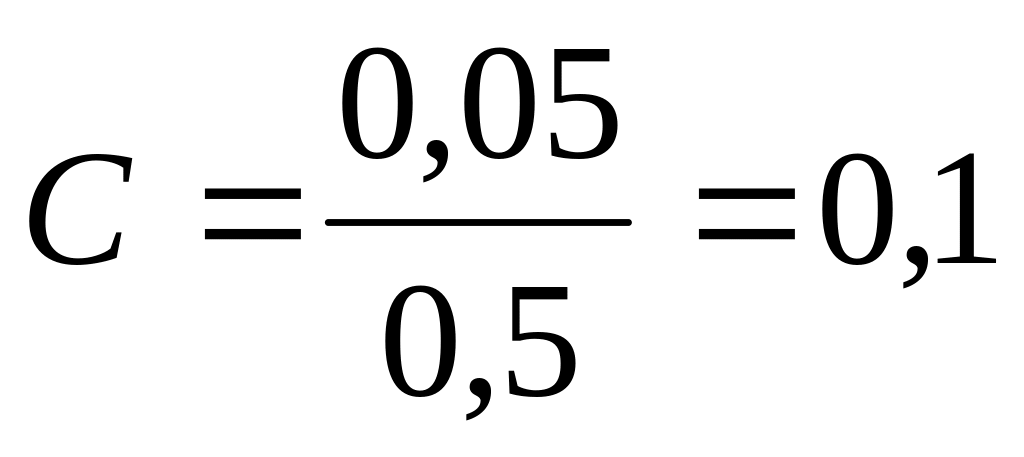
pH = - lg 0,1 = 1
Ответ: pH =1
pH = ?
17. В 1 л раствора HNO3, имеющего pH=1, содержится Х моль кислоты.
1) 0,1
2) 0,2
3) 0,5
4) 10
-
Дано:
pH = 1
V HNO3 =1 л
Решение:
[H+ ]=10-1
[H+ ] = CHNO3
10-1 = 0,1
Ответ: n=0,1 моль
n = ?
Для самостоятельного решения
Тема заданий: «Физико-химические и физические методы анализа»
1.Метод анализа, основанный на зависимости потенциала электрода от концентрации ионов называется:
1) кондуктометрия; 2) полярография;
3) кулонометрия; 4) потенциометрия
2.Метод анализа, основанный на зависимости электропроводности раствора от концентрации электролита:
1) потенциометрия; 2) кулонометрия;
3) полярография; 4) кондуктометрия
3.Метод анализа, основанный на измерении количества электричества, расходуемого при выделении на электроде того или иного вещества:
1) кулонометрия; 2) потенциометрия
3) кондуктометрия; 4) полярография;
4. Метод анализа, основанный на изучении полярограмм (вольт-амперных кривых), получаемых при электролизе исследуемого вещества с ртутно-капельным электродом:
1) полярография; 2) кондуктометрия
3) потенциометрия; 4) кулонометрия
.
