
- •II начало термодинамики.
- •Постулат планка
- •Применение I и II законов термодинамики к химическим процессам.
- •Характеристические функции. Уравнение гиббса — гельмгольца
- •Уравнения Гиббса — Гельмгольца.
- •Свойства функции гиббса
- •Новое главное уравнение термодинамики
- •Влияние температуры на функцию Гиббса.
- •Влияние температуры на функцию Гиббса.
- •Для реального газа:
- •Зависимость функции Гиббса от состава
II начало термодинамики.
![]()
Самопроизвольные необратимые процессы всегда ведут к выравниванию интенсивных параметров, в том числе и Т.
Обратимые – процессы, которые при бесконечно малом изменении действующих на систему сил могут идти, как в прямом, так и в обратном направлении, и без изменения работоспособности системы в обоих направлениях. Т.к. действующие силы малы, то такие процессы протекают бесконечно медленно (процессы в гальваническом элементе, все фазовые переходы).
Задача II начала ТД: ответить на вопрос – какие процессы могут идти самопроизвольно?
Формулировки:
Кельвин – Планк: невозможен круговой процесс, единственным результатом которого является превращение теплоты в работу (т.е. процесс превращения теплоты в работу необратим);
предложена Клаузиусом: Теплота не может переходить сама собой от менее нагретого тела к более нагретому (т.е. процесс теплопроводности необратим);
Оствальд: невозможно построить такую периодически действующую машину (вечный двигатель второго рода), все действия которого сводились бы к производству работы и соответствующему охлаждению источника.
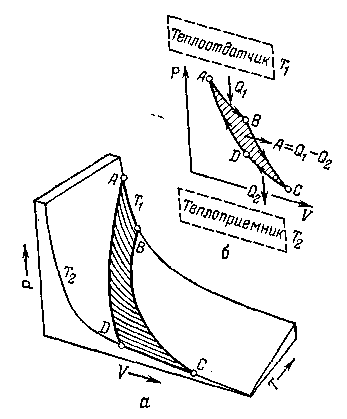
Рисунок. Цикл Карно (а) и термодинамическая схема тепловой машины (б).
Теорема Карно– Клаузиуса:
коэффициент полезного действия машины (КПД) при работе по обратимому циклу не зависит от природы рабочего тела, а определяется только интервалом температур, в котором совершается работа:
![]()
.
для элементарного цикла Карно:
![]() или
или
![]()
для бесконечно малого цикла Карно:
![]() или
или
![]()
для конечного цикла Карно
или в пределе может быть заменена интегралом по замкнутому контуру:
![]()
![]()
![]() ,
где
,
где
![]()
![]() – аналитическое
уравнение II
закона термодинамики
– аналитическое
уравнение II
закона термодинамики
![]()
![]()
![]()
![]() –
–
фундаментальное уравнение термодинамики
Если процесс необратим, то КПД меньше, чем в обратимом:
 ;
;

в пределе
![]() ,
т.е.
,
т.е.
![]() и
и
![]() .
.
-
Неизолированные системы
Обратимые процессы
Необратимые процессы
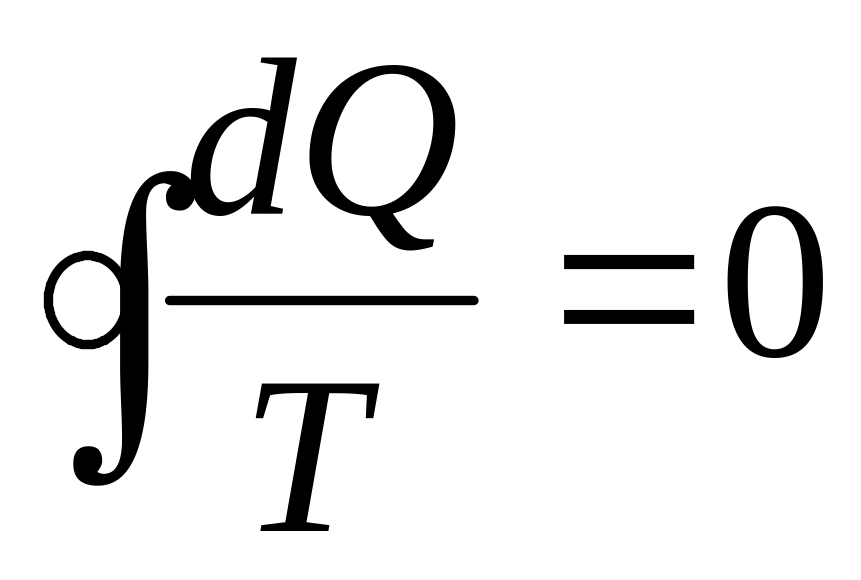
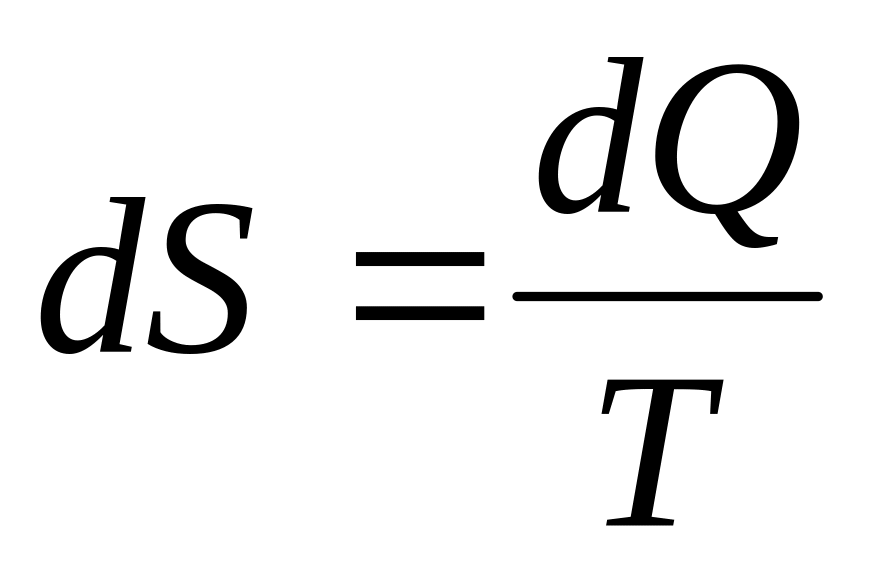

Изолированные системы



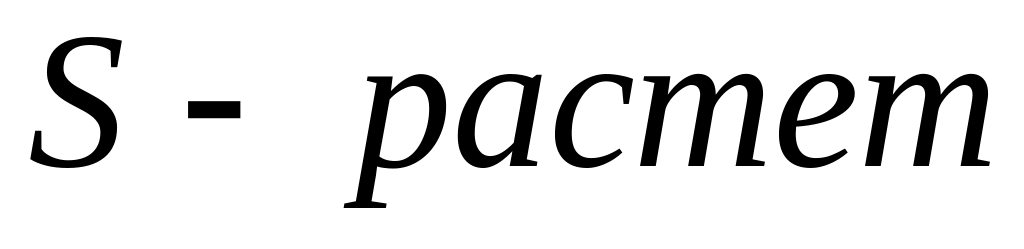
(только при условии U и V=const или H и p=const)
Совместное уравнение первого и второго начала термодинамики:
![]()
![]()
![]()
![]() и
и
![]() .
.
В изолированных системах:
всякий самопроизвольный процесс сопровождается возрастанием энтропии,
этот процесс идет до тех пор, пока система не придет в равновесное состояние, при котором S достигает максимального значения, т.е. при равновесии dS=0,
Равновесное состояние является наиболее вероятным, то, следовательно, энтропия может служить мерой вероятности данного процесса.
Примеры расчетов изменения энтропии идеального газа в различных процессах.
изотермическое расширение (сжатие) от начального состояния (
 ;
;
 )
до конечного состояния (
)
до конечного состояния ( ;
;
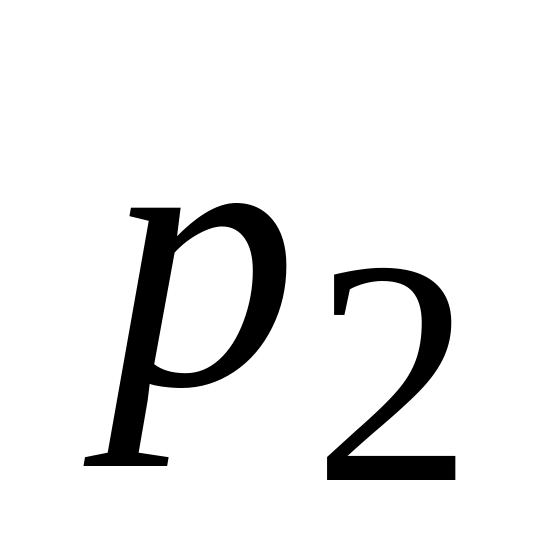 ):
):
Для обратимого
процесса:
![]()
Т.к.
![]() ,
то
,
то
![]() ,
то
,
то
![]() .
.
 .
.
![]() .
.


![]()
Пример.
Рассчитайте изменение энтропии в процессе изотермического расширения 10 г криптона от объема 0,05 м3 до объема 0,2 м3 при температуре 500 К.
Решение.
Для решения задачи
воспользуемся формулой
![]()
![]() .
.
нагревание (охлаждение) без фазового перехода:
в общем случае:
 .
.
В случае процесса:
-
изохорный

изобарный





Если
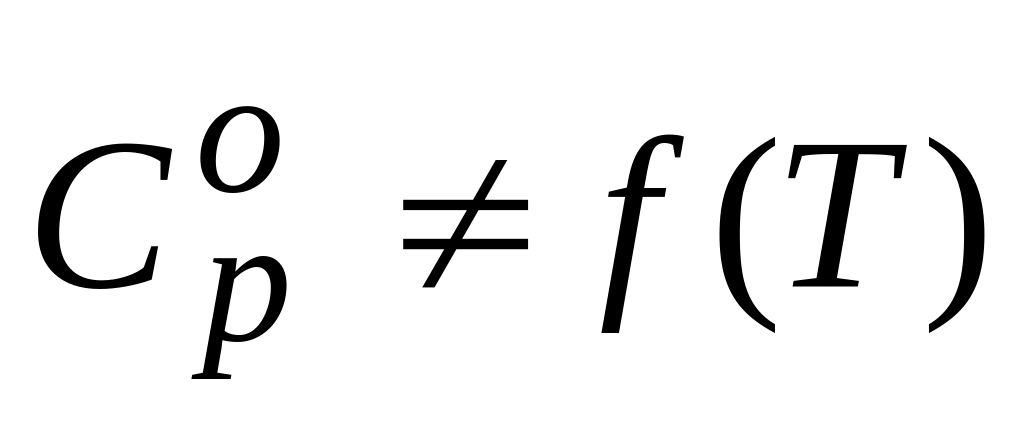

.
Изменение энтропии идеального газа одновременном изменении давления (или объема) системы и температуры:
Пример.
Рассчитайте
изменение энтропии, происходящее при
расширении до 400 см3
и одновременном нагревании до 50 ºС
криптона (![]() ),
содержащегося в контейнере объемом 100
см3
при 25 ºС а давлении
),
содержащегося в контейнере объемом 100
см3
при 25 ºС а давлении
![]() Па.
Па.
Решение.
-
Начальное состояние


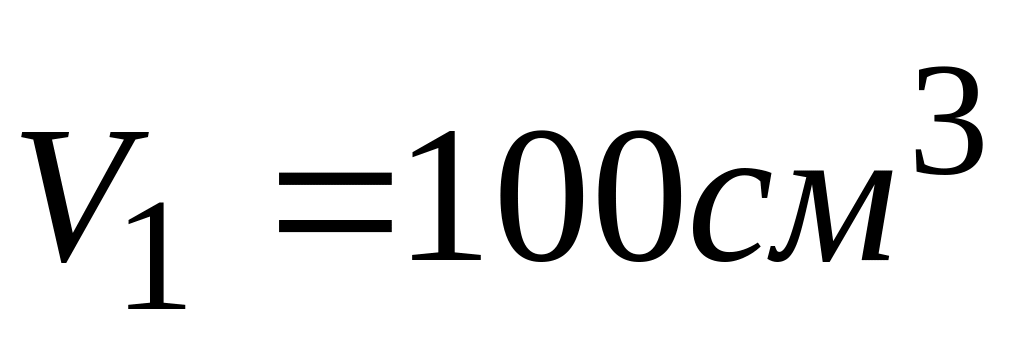
т.е.

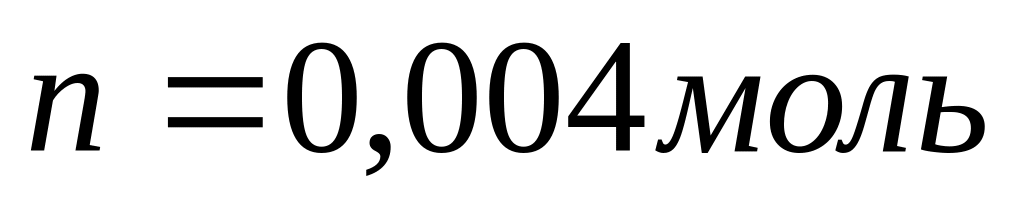

Конечное состояние
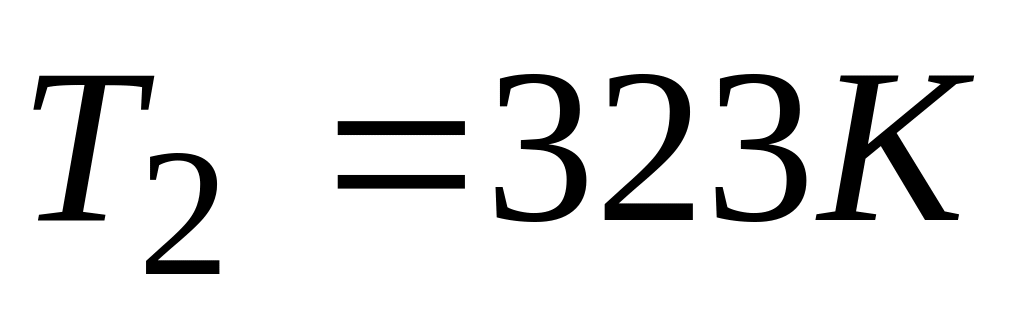

В данном случае систему можно перевести из начального состояния в конечное в две стадии:
изотермическое расширение от до , при этом
 ;
;изохорное нагревание от
 до
до
 ,
при этом
,
при этом
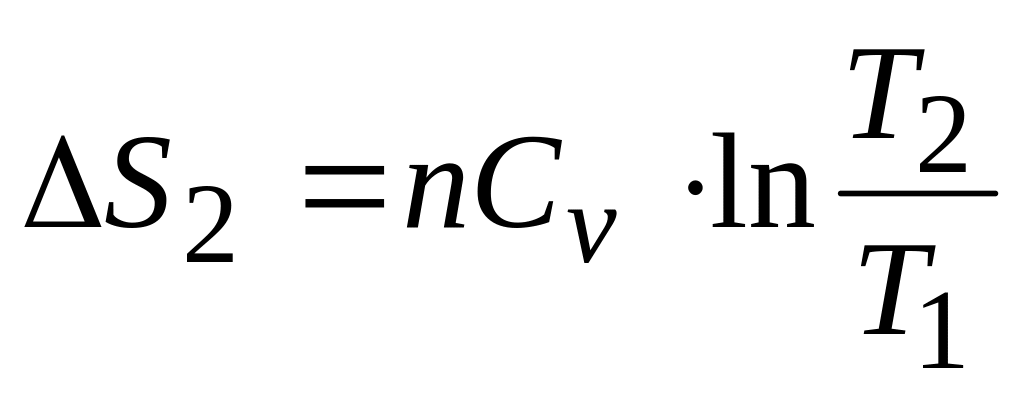 .
.
Начальное состояние
|
|
Конечное состояние
|
|||
|
|||||
|
Изотермическое расширение |
|
Изохорное нагревание |
|
|
|
|
Промежуточное состояние
|
|
||
Т.е.
![]()
![]() .
.
Изменение энтропии идеального газа при фазовом переходе:
![]()
где
![]() – энтальпия фазового перехода.
– энтальпия фазового перехода.
Пример.
Рассчитайте изменение энтропии при испарении 0,5 моль метанола ( Па) без учета зависимости теплоемкости от температуры. Нормальная температура кипения метанола равна 64,7 ºС.
Решение.
Процесс испарения
метанола
![]() ,
,
![]() .
.
Для расчетов используем формулу ,
где
![]() .
.
Выпишем из справочника необходимые данные:
![]() ,
,
![]()
Следовательно,
![]() .
.
Изменение энтропии в процессе химической реакции.
Пример.
Пользуясь данными таблицы стандартных термодинамических характеристик веществ, определите изменение энтропии химической реакции:
![]()
при температурах 400К и 1400К и стандартных исходных давлениях реагентов.
Решение.
Данные для решения задачи берем из справочника:
|
S, Дж/(мольК) |
Теплоемкость, Дж/(мольК) |
|||
Ср |
a |
|
|
||
СO |
197,55 |
29,14 |
28,41 |
4,1 |
-0,46 |
Cl2 |
222,98 |
33,93 |
37,03 |
0,67 |
-2,85 |
COCl2 |
283,64 |
57,76 |
67,15 |
12,03 |
-9,04 |
Рассмотрим два варианта расчета:
Без учета зависимости теплоемкости от температуры:
![]()
(коэффициенты не учитываем, т.к. они все равны единице);
![]()
Тогда,
![]()
Температура, К |
|
400 |
|
1400 |
|
С учетом зависимости теплоемкости от температуры:
![]() ,
,
где ,
![]() ,
,
![]()
т.е. формула для
расчета
![]() :
:
 ,
,
после интегрирования получаем:
![]()
Температура, К |
Дж/К
|
400 |
|
1400 |
|
