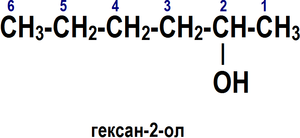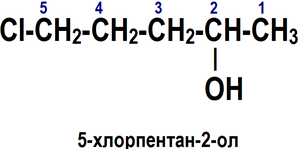- •Свойства химических элементов, а также образованных ими веществ находятся в периодической зависимости от заряда ядра атома.
- •Химические свойства
- •Галогенирование
- •Гидрогалогенирование
- •Гидратация
- •Окисление
- •Исчерпывающее окисление
- •Восстановление (гидрирование)
- •Озонирование
- •Химические свойства
- •Нахождение в природе
- •Получение
- •Номенклатура алкинов
- •Изомерия
- •Химические свойства
- •1. Реакции присоединения
- •II Кислотные свойства
- •Классификация неорганических веществ
- •Химические свойства
- •Химические свойства
- •Химические свойства спиртов.
- •Номенклатура спиртов [править]Систематическая номенклатура
- •[Править]Рациональная и тривиальная номенклатура
- •Физические свойства спиртов.
- •Основные положения теории химического строения а.М. Бутлерова
- •Положение металлов в периодической таблице
- •Химические свойства
- •3 Реакция полимеризации
- •Номенклатура
- •Изомерия
- •[Править]Гомологический ряд
- •Химические свойства карбоновых кислот.
- •Химические свойства спиртов.
- •Номенклатура спиртов [править]Систематическая номенклатура
- •[Править]Рациональная и тривиальная номенклатура
- •Химические свойства
- •Галогенирование
- •Гидрогалогенирование
- •Гидратация
- •Окисление
- •Исчерпывающее окисление
- •Восстановление (гидрирование)
- •Озонирование
- •Номенклатура
- •Изомерия
- •Гомологический ряд
Химические свойства
Основные оксиды |
Кислотные оксиды |
1. Взаимодействие с водой |
|
Образуется основание: Na2O + H2O ® 2NaOH CaO + H2O ® Ca(OH)2 |
Образуется кислота: SO3 + H2O ® H2SO4 P2O5 + 3H2O ® 2H3PO4 |
2. Взаимодействие с кислотой или основанием: |
|
При реакции с кислотой образуется соль и вода MgO + H2SO4 –t°® MgSO4 + H2O CuO + 2HCl –t°® CuCl2 + H2O |
При реакции с основанием образуется соль и вода CO2 + Ba(OH)2 ® BaCO3 + H2O SO2 + 2NaOH ® Na2SO3 + H2O |
Амфотерные оксиды взаимодействуют |
|
с кислотами как основные: ZnO + H2SO4 ® ZnSO4 + H2O |
с основаниями как кислотные: ZnO + 2NaOH ® Na2ZnO2 + H2O (ZnO + 2NaOH + H2O ® Na2[Zn(OH)4]) |
3. Взаимодействие основных и кислотных оксидов между собой приводит к солям. |
|
Na2O + CO2 ® Na2CO3 |
|
4. Восстановление до простых веществ: |
|
3CuO + 2NH3 ® 3Cu + N2 + 3H2O P2O5 + 5C ® 2P + 5CO |
|
№2.Предельные одноатомные спирты. Гомологический ряд, изомерия номенклатура, физические и химические свойства, применение.
Спирты (или алканолы) — органические вещества, молекулы которых содержат одну или несколько гидроксильных групп (групп –ОН), соединенных с углеводородным радикалом.
Химические свойства спиртов.
Атом кислорода, входящий в гидроксильную группу молекул спиртов, отличается от атомов водорода и углерода по способности притягивать и удерживать электронные пары. Благодаря этому в молекулах спиртов имеются полярные связи С-О и О-Н. Вследствие полярности связи О-Н и значительного частичного положительного заряда, локализованного (сосредоточенного) на атоме водорода, водород гидроксильной группы имеет кислотный характер.
Связи С-О и О-Н сильно полярные и способны к разрыву.
А. Реакции с разрывом связи О-Н.
1). Реагируют со щелочными металлами, проявляя кислотные свойства:
2С2Н5ОН + 2K→ 2С2Н5ОK + Н2↑
но не реагируют с щелочами.
2). Взаимодействуют с минеральными и органическими кислотами, образуя сложные эфиры:
Н+
С2Н5ОН
+ СН3СООН ![]() СН3СООС2Н5 +
Н2О
СН3СООС2Н5 +
Н2О
C2H5OH + HONO2 C2H5ONO2 + Н2O
3). Спирты окисляются до карбонильных соединений:
[O] [О] R-CH2-OH → R-CH=O → R-COOH
Б. Реакции с разрывом связи С-О.
1). Реакции дегидратации:
- с образованием алкенов
H2SO4, t >150°С СН3-СН2-СН2-ОН→СН3-СН=СН2+ Н2О.
- с образованием простых эфиров
H2SO4, t< 150°С 2CH3-CH2-OH→C2H5-O-C2H5+ H2O
2.) Спирты обратимо реагируют галогеноводородными кислотами:
ROH + HCl RCl + Н2О
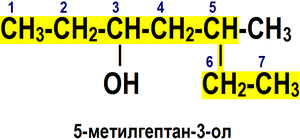
Номенклатура спиртов [править]Систематическая номенклатура
Основная статья: Систематическая номенклатура спиртов, фенолов и их производных
По номенклатуре ИЮПАК названия простых спиртов образуются от названий соответствующих алканов с добавлением суффикса «-ол», положение которого указывается арабской цифрой.
Правила построения названия спиртов (функциональная группа −OH)[6]:
1. Выбирается родительский углеводород по самой длинной непрерывной углеводородной цепи, содержащей функциональную группу. Он формирует базовое название (по числу атомов углерода).
|
|
2. Родительский углеводород нумеруется в направлении, которое дает суффиксу функциональной группы самое низкое число.
3. Если в соединении помимо функциональной группы имеется другой заместитель, суффикс функциональной группы получает самое низкое число.
|
4. Если для суффикса функциональной группы получено одно и то же число в обоих направлениях, цепь нумеруется в направлении, которое дает другому заместителю самое низкое число.
5. Если имеется несколько заместителей, они перечисляются в алфавитном порядке.
Имена заместителей ставятся перед именем родительского углеводорода, а суффикс функциональной группы — после. ИЮПАК рекомендует цифру, характеризующую положение функциональной группы, писать сразу после имени углеводородного заместителя перед суффиксом функциональной группы.
Для многоатомных спиртов перед суффиксом -ол по-гречески (-ди-, -три-, …) указывается количество гидроксильных групп (например: пропан-1,2,3-триол).