
- •Свойства химических элементов, а также образованных ими веществ находятся в периодической зависимости от заряда ядра атома.
- •Химические свойства
- •Галогенирование
- •Гидрогалогенирование
- •Гидратация
- •Окисление
- •Исчерпывающее окисление
- •Восстановление (гидрирование)
- •Озонирование
- •Химические свойства
- •Нахождение в природе
- •Получение
- •Номенклатура алкинов
- •Изомерия
- •Химические свойства
- •1. Реакции присоединения
- •II Кислотные свойства
- •Классификация неорганических веществ
- •Химические свойства
- •Химические свойства
- •Химические свойства спиртов.
- •Номенклатура спиртов [править]Систематическая номенклатура
- •[Править]Рациональная и тривиальная номенклатура
- •Физические свойства спиртов.
- •Основные положения теории химического строения а.М. Бутлерова
- •Положение металлов в периодической таблице
- •Химические свойства
- •3 Реакция полимеризации
- •Номенклатура
- •Изомерия
- •[Править]Гомологический ряд
- •Химические свойства карбоновых кислот.
- •Химические свойства спиртов.
- •Номенклатура спиртов [править]Систематическая номенклатура
- •[Править]Рациональная и тривиальная номенклатура
- •Химические свойства
- •Галогенирование
- •Гидрогалогенирование
- •Гидратация
- •Окисление
- •Исчерпывающее окисление
- •Восстановление (гидрирование)
- •Озонирование
- •Номенклатура
- •Изомерия
- •Гомологический ряд
Получение
Синтез Лебедева:
2CH3-CH2-OH --Al2O3, ZnO, t--> CH2=CH-CH=CH2 + 2H2O + H2
Формально эту реакцию можно представить как дегидратацию двух молекул этилового спирта с одновременным межмолекулярным дегидрированием.
|
|
|
|
|
|
Билет№5.
№1. Непредельные углеводороды-алкины. Гомологический ряд, изомерия, номенклатура, хим.свойства, применение.
Алки́ны (иначе ацетиленовые углеводороды) — углеводороды, содержащие тройную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n-2. Атомы углерода при тройной связи находятся в состоянии sp-гибридизации. HCєCH.
Для алкинов характерны реакции присоединения. В отличие от алкенов, которым свойственны реакции электрофильного присоединения, алкины могут вступать также и в реакции нуклеофильного присоединения. Это обусловлено значительным s-характером связи и, как следствие, повышенной электроотрицательностью атома углерода. Кроме того, большая подвижность атома водорода при тройной связи обуславливает кислотные свойства алкинов в реакциях замещения.
Номенклатура алкинов
Простейшим алкином является этин (ацетилен C2H2). По номенклатуре IUPAC названия алкинов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ин»; положение тройной связи указывается арабскими цифрами.
Углеводородные радикалы, образованные от алкинов имеют суффикс «-инил», так CH≡C- называется «этинил».
Ниже представлены некоторые представители алкинов и их названия:
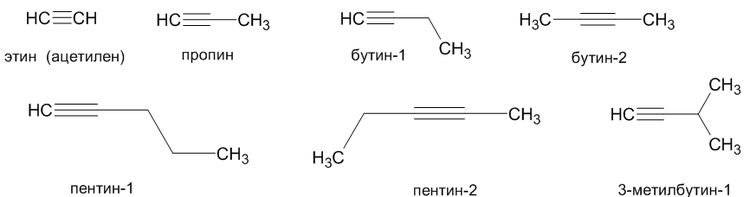
Различают внутреннюю тройную связь (пример: бут-2-ин) и концевую (пример: бут-1-ин).
Гомологический ряд алкинов:
Этин: C2H2
Пропин: C3H4
Бутин: C4H6
Пентин: C5H8
Гексин: C6H10
Гептин: C7H12
Октин: C8H14
Нонин: C9H16
Децин: C10H18
Изомерия
Алкинам свойственна изомерия углеродного скелета (начиная с C5H8), изомерия положения тройной связи (начиная с C4H6) и межклассовая изомерия с алкадиенами.
Химические свойства
Углеродные атомы в молекуле ацетилена находятся в состоянии sp-гибридизации. Это означает, что каждый атом углерода обладает двумя гибридными sp- орбиталями, оси которых расположены на одной линии под углом 180° друг к другу, а две p- орбитали остаются негибридными. sp- Гибридные орбитали двух атомов углерода в состоянии, предшествующем образованию тройной связи и связей C–H
По одной из двух гибридных орбиталей каждого атома углерода взаимно перекрываются, приводя к образованию s- связи между атомами углерода. Каждая оставшаяся гибридная орбиталь перекрывается с s- орбиталью атома водорода, образуя s- связь С–Н. Схематическое изображение строения молекулы ацетилена (ядра атомов углерода и водорода на одной прямой, две p- связи между атомами углерода находятся в двух взаимно перпендикулярных плоскостях)
Две негибридные p- орбитали каждого атома углерода, расположенные перпендикулярно друг другу и перпендикулярно направлению s- связей, взаимно перекрываются и образуют две p- связи. Таким образом, тройная связь характеризуется сочетанием одной s- и двух p- связей. Для алкинов характерны все реакции присоединения, свойственные алкенам, однако у них после присоединения первой молекулы реагента остается еще одна p- связь (алкин превращается в алкен), которая вновь может вступать в реакцию присоединения со второй молекулой реагента. Кроме того, "незамещенные" алкины проявляют кислотные свойства, связанные с отщеплением протона от атома углерода, составляющего тройную связь (єС–Н).
