
- •Свойства химических элементов, а также образованных ими веществ находятся в периодической зависимости от заряда ядра атома.
- •Химические свойства
- •Галогенирование
- •Гидрогалогенирование
- •Гидратация
- •Окисление
- •Исчерпывающее окисление
- •Восстановление (гидрирование)
- •Озонирование
- •Химические свойства
- •Нахождение в природе
- •Получение
- •Номенклатура алкинов
- •Изомерия
- •Химические свойства
- •1. Реакции присоединения
- •II Кислотные свойства
- •Классификация неорганических веществ
- •Химические свойства
- •Химические свойства
- •Химические свойства спиртов.
- •Номенклатура спиртов [править]Систематическая номенклатура
- •[Править]Рациональная и тривиальная номенклатура
- •Физические свойства спиртов.
- •Основные положения теории химического строения а.М. Бутлерова
- •Положение металлов в периодической таблице
- •Химические свойства
- •3 Реакция полимеризации
- •Номенклатура
- •Изомерия
- •[Править]Гомологический ряд
- •Химические свойства карбоновых кислот.
- •Химические свойства спиртов.
- •Номенклатура спиртов [править]Систематическая номенклатура
- •[Править]Рациональная и тривиальная номенклатура
- •Химические свойства
- •Галогенирование
- •Гидрогалогенирование
- •Гидратация
- •Окисление
- •Исчерпывающее окисление
- •Восстановление (гидрирование)
- •Озонирование
- •Номенклатура
- •Изомерия
- •Гомологический ряд
Исчерпывающее окисление
Алкены (как и алканы) на воздухе или в кислороде сгорают до углекислого газа и воды: С2Н4+3O2=2СO2+2Н2O
Восстановление (гидрирование)
Взаимодействие алкенов с водородом происходит в присутствии металлических катализаторов (Ni, Pd, Pt и др.) при нагревании: СН3—СН=СН2+Н2СН3—СН2—СН3
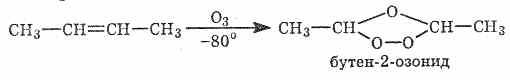
Озонирование
Большинство алкенов даже при низких температурах реагируют с озоном: разрывается двойная связь и образуются циклические перекисные производные, известные под названием озонидов.
Билет№3
№1.Виды химической связи: ионная, ковалентная, водородная, металлическая.
Ковалентной связью называется химическая связь между двумя атомами за счет образования общей электронной пары. Ковалентная связь может быть неполярной — между двумя атомами с одинаковой электроотрицательностью, т.е. в простых веществах, и полярной — между атомами, электроотрицательность которых различается, т.е. в сложных веществах.
Рассмотреть образование ковалентной неполярной связи удобно на примере молекулы водорода, образующейся при соединении двух атомов водорода, каждый из которых имеет по одному неспаренному электрону:
H• + •H → H : H
При этом внешняя электронная оболочка получает недостающий электрон, становится завершенной.
Такое состояние характеризуется меньшей энергией, более устойчиво. Вот почему для разрыва ковалентной связи требуется затратить энергию (такое же количество энергии выделяется при ее образовании).
В структурных формулах ковалентная связь изображается черточкой, тогда молекула водорода будет выглядеть так: H–H
Еще раз обращаем Ваше внимание, что ковалентной называется двухэлектронная двухцентроваясвязь, когда два электрона находятся на общей орбитали двух атомов. Поэтому к ней, строго говоря, не относятся случаи, когда электроны находятся на орбиталях трех или более атомов или когда общая связь образована более чем двумя электронами (в 10–11 классах будет изучаться бензол, в молекуле которого 6 электронов образуют одну общую связь).
Ковалентная полярная связь образуется в молекуле хлороводорода:
.. .. H· + ·Cl: → H :Cl: ·· ··
Хлор как более электроотрицательный элемент смещает к себе общую электронную пару, в результате на нем образуется частичный отрицательный заряд, а на водороде — частичный положительный:
Hδ+–Clδ−
Ковалентная связь может возникать не только при объединении двух орбиталей, содержащих по одному неспаренному электрону. Один атом может предоставить электронную пару, а второй — свободную орбиталь. Такая ковалентная связь называется донорно-акцепторной.
Например, в ионе аммония протон присоединяется к молекуле аммиака за счет образования донорно-акцепторной связи. Азот выступает донором, а протон (водород) — акцептором электронной пары:
H+ + :NH3 → NH4+
Хотя по способу образования донорно-акцепторная связь отличается от остальных, но по свойствам, в том числе по длине связи, все четыре связи одинаковы.
Чтобы подчеркнуть способ образования, донорно-акцепторную связь могут обозначать в структурных формулах стрелкой: H l [H — N → H ]+ l H Стрелку используют и чтобы изобразить смещение общей электронной пары в полярной связи (H→Cl), поэтому эти два случая не следует путать.
Ионную связь можно рассматривать как крайний случай ковалентной полярной связи, когда электроны практически полностью переходят от одних атомов к другим с образованием ионов.
Таким образом, ионная связь образуется за счет сил электростатического притяжения между ионами (притягиваются противоположные заряды).
Примером ионной связи будет хлорид натрия:
.. Na+ [:Cl:] − ··
Ионная связь характерна для соединений элементов, электроотрицательности которых различаются очень сильно, например щелочных металлов с галогенами.
Сходство с ковалентной связью заключается в том, что сложно провести резкую грань между ковалентной полярной и ионной связью, мнения разных авторов на этот счет могут различаться.
Различие ионной и ковалентной связи в том, что ионная сильнее поляризована, вплоть до полного перехода электронной пары к более электроотрицательному элементу.
Типы кристаллических решеток:
1. Ионная — в узлах кристаллической решетки расположены положительные и отрицательные ионы. Характерна для веществ с ионной связью: соединений галогенов с щелочными металлами (NaCl), щелочей (NaOH) и солей кислородсодержащих кислот (Na2SO4).
2. Атомная — в узлах кристаллической решетки атомы, связанные ковалентными связями: алмаз, кремний.
Вещества с ионными и атомными кристаллическими решетками обладают высокими твердостью и температурой плавления.
3. Молекулярная кристаллическая решетка образована молекулами, связанными слабыми межмолекулярными взаимодействиями, поэтому такие вещества непрочные, легкоплавкие (лёд, сера), зачастую возгоняются, т.е. при нагревании испаряются, минуя жидкую фазу, как сухой лёд CO2, йод I2
4. Металлическая кристаллическая решетка характерна для металлов, например, Fe
Металлическая связь- существует в металлах в твердом в жидком состоянии. В соответствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов (1-3 электрона) и низкую энергию ионизации (отрыва электрона). Поэтому валентные электроны слабо удерживаются в атоме, легко отрываются и имеют возможность перемещаться по всему кристаллу. В узлах кристаллической решетки металлов находятся свободные атомы, положительно заряженные коны, а часть валентных электронов, свободно перемещаясь в объеме кристаллической решетки, образует «электронный газ», обеспечивающий связь между атомами металла. Связь, которую осуществляют относительно свободные электроны между ионами металлов в кристаллической решетке, называется металлической связью. Металлическая связь возникает за счет обобществления атомами валентных электронов. Однако между этими видами связи есть существенное различие. Электроны, осуществляющие ковалентную связь, в основном пребывают в непосредственной близости от двух соединенных атомов. В случае металлической связи электроны, осуществляющие связь, перемещаются по всему куску металла. Этим определяются общие признаки металлов: металлический блеск, хорошая проводимость теплоты и электричества, ковкость, пластичность и т. д. Общим химическим свойством металлов является их относительно высокая восстановительная способность. Водородные связи -могут образовываться между атомом водорода, связанным с атомом электроотрицательного элемента, и электроотрицательным элементом, имеющим свободную пару электронов(О,F,N). Водородная связь обусловлена электростатическим притяжением, которому способствуют малые размеры атома водорода, и отчасти, донорно-акцепторным взаимодействием. Водородная связь может быть межмолекулярной и внутримолекулярной. Связи 0-Н имеют выраженный полярный характер: Водородная связь гораздо более слабая, чем ионная или ковалентная, но более сильная, чем межмолекулярное взаимодействие. Водородные связи обуславливают некоторые физические свойства веществ (например, высокие температуры кипения). Особенно распространены водородные связи в молекулах белков, нуклеиновых кислот и других биологически важных соединений, обеспечивая им определенную пространственную структуру (организацию).
№2. Циклоалканы. Хим.свойства. Нахождение в природе.
Циклоалканы, также нафтены, цикланы, или циклопарафины — циклические насыщенные углеводороды, по химическим свойствам близки к предельным углеводородам. Входят в состав нефти. Открыты В. В. Марковниковым в 1883 году из Бакинской нефти. Марковников назвал их "Нафтенами" от тюркского "нафт"-"нефть".[источник не указан 512 дней]
В нефтехимической промышленности нафтены являются источником получения ароматических углеводородов путем каталитического риформинга. Наибольшее практическое значение приобрёл циклогексан, применяемый для синтеза капролактама, адипиновой кислоты и других соединений, используемых в производстве синтетического волокна.
К циклоалканам относят предельные углеводороды с общей формулой СnH2n, имеющие циклическое строение. Названия циклоалканов строятся из названий соответствующих алканов с добавлением приставки «цикло», например циклопропан, 1,3-диметилциклогексан. Для циклоалканов характерны следующие виды изомерии:
Изомерия углеродного скелета
Пространственная (цис-транс-изомерия)
Межклассовая изомерия с алкенами
Все атомы углерода в молекулах циклоалканов имеют sp3-гибридизацию. Однако величины углов между гибридными орбиталями в циклобутане и особенно в циклопропане не 109°28', а меньше из-за геометрии, что создает в молекулах напряжение, поэтому малые циклы очень реакционноспособны.
Циклопропан применяют для наркоза, но его применение ограничено из-за взрывоопасности.
