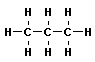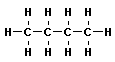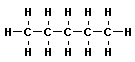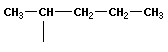- •Свойства химических элементов, а также образованных ими веществ находятся в периодической зависимости от заряда ядра атома.
- •Химические свойства
- •Галогенирование
- •Гидрогалогенирование
- •Гидратация
- •Окисление
- •Исчерпывающее окисление
- •Восстановление (гидрирование)
- •Озонирование
- •Химические свойства
- •Нахождение в природе
- •Получение
- •Номенклатура алкинов
- •Изомерия
- •Химические свойства
- •1. Реакции присоединения
- •II Кислотные свойства
- •Классификация неорганических веществ
- •Химические свойства
- •Химические свойства
- •Химические свойства спиртов.
- •Номенклатура спиртов [править]Систематическая номенклатура
- •[Править]Рациональная и тривиальная номенклатура
- •Физические свойства спиртов.
- •Основные положения теории химического строения а.М. Бутлерова
- •Положение металлов в периодической таблице
- •Химические свойства
- •3 Реакция полимеризации
- •Номенклатура
- •Изомерия
- •[Править]Гомологический ряд
- •Химические свойства карбоновых кислот.
- •Химические свойства спиртов.
- •Номенклатура спиртов [править]Систематическая номенклатура
- •[Править]Рациональная и тривиальная номенклатура
- •Химические свойства
- •Галогенирование
- •Гидрогалогенирование
- •Гидратация
- •Окисление
- •Исчерпывающее окисление
- •Восстановление (гидрирование)
- •Озонирование
- •Номенклатура
- •Изомерия
- •Гомологический ряд
Билет №1
1.Переодический закон, периодическая система химических элементов Д.И.Менделеева.
Периодическая система стала одним из важнейших источников информации о химических элементах, образуемых ими простых веществах и соединениях.
Дмитрий Иванович Менделеев создал Периодическую систему в процессе работы над своим учебником «Основы химии», добиваясь максимальной логичности в изложении материала. Закономерность изменения свойств элементов, образующих систему, получила название Периодического закона. Согласно периодическому закону, сформулированному Менделеевым в 1869 году, свойства химических элементов находятся в периодической зависимости от их атомных масс. То есть с увеличением относительной атомной массы, свойства элементов периодически повторяются.* Сравните: периодичность смены времен года с течением времени. Данная закономерность иногда нарушается, например, аргон (инертный газ) превышает по массе следующий за ним калий (щелочной металл). Это противоречие было объяснено в 1914 году при изучении строения атома. Порядковый номер элемента в Периодической системе — это не просто очередность, он имеет физический смысл — равен заряду ядра атома. Поэтому
современная формулировка Периодического закона звучит так:
Свойства химических элементов, а также образованных ими веществ находятся в периодической зависимости от заряда ядра атома.
Период — это последовательность элементов, расположенных в порядке возрастания заряда ядра атома, начинающаяся щелочным металлом и заканчивающаяся инертным газом.
В периоде, с увеличением заряда ядра, растет электроотрицательность элемента, ослабевают металлические (восстановительные) свойства и растут неметаллические (окислительные) свойства простых веществ. Так, второй период начинается щелочным металлом литием, за ним следует бериллий, проявляющий амфотерные свойства, бор — неметалл, и т.д. В конце фтор — галоген и неон — инертный газ.
(Третий период снова начинается щелочным металлом — это и есть периодичность)
1–3 периоды являются малыми (содержат один ряд: 2 или 8 элементов), 4–7 — большие периоды, состоят из 18 и более элементов.
Составляя периодическую систему, Менделеев объединил известные на тот момент элементы, обладающие сходством, в вертикальные столбцы. Группы – это вертикальные столбцы элементов, имеющих, как правило, валентность в высшем оксиде равную номеру группы. Группу делят на две подгруппы:
Главные подгруппы содержат элементы малых и больших периодов, образуют семейства со сходными свойствами (щелочные металлы — I А, галогены — VII A, инертные газы — VIII A).
(химические знаки элементов главных подгрупп в периодической системе располагаются под буквой «А» или, в очень старых таблицах, где нет букв А и Б — под элементом второго периода)
Побочные подгруппы содержат элементы только больших периодов, их называют переходные металлы.
(под буквой «Б» или «B»)
В главных подгруппах с увеличением заряда ядра (атомного номера) растут металлические (восстановительные) свойства.
* точнее, веществ, образованных элементами, но это часто опускают, говоря «свойства элементов»
Периодический закон был открыт Д.И.Менделеевым, в то время, когда в науке господствовало атомно-молекулярное учение, согласно которому атомы химических элементов отличаются друг от друга размерами, свойствами, массой.
Периодический закон- свойства химических элементов, а также свойства соединений элементов находятся в периодической зависимости от величины заряда атомных ядер
На основе периодического закона Д.И.Менделеева составил естественную классификацию химических элементов- периодическую систему, которая отражена в таблице «Периодическая система химических элементов. Она состоит из семи периодов и восьми групп, что же такое периодическая система?
Периодическая система- графическое отображение Периодического закона, в которой элеенты расположены в порядке возрастания зарядов ядер их атомов.
Период- горизонтальный ряд элементов, расположенных в порядке возрастания зарядов ядер их атомов, начинающийся щелочным металлом( 1-ый период-водородом) и заканчивающийся инертным газом.
Малые периоды- включают элементы только главных подгрупп (s-и-p-элементы), 2 элемента(1-ый период) или 8 элементов( 2,3 периоды)
Большие периоды- включают элементы и главных и побочных подгрупп(s-p-d-f) ,18 элементов(4,5 периоды) или 32(6 период) 7 период еще не закончен.
Группа- вертикальный ряд элементов,, расположенных в порядке возрастания зарядов ядер их атомов, имеющих одинаковую электронную конфигурацию внешних энергетических уровней. Каждые группы делятся на две подгруппы: главную и побочную
Главные подгруппы- включают элементы и малых и больших периодов, у которых последними заполняются электронами s-и –p подуровни,(например в в гл. подгруппе Vгруппы азот-неметалл, а висмут-металл.
Побочные подгруппы- включают элементы только больших периодов, у которых последними заполняются электронами предшествующие энергетические уровни (d-или-f-подуровни)
2.Предельные углеводороды-алканы. Гомологический ряд, изомерия, номенлатура, хим.свойства.
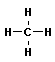
Алканы (парафины) – алифатические (нециклические) предельные углеводороды, в которых атомы углерода связаны между собой простыми (одинарными) связями в неразветвленные или разветвленные цепи. Алканы имеют общую формулу CnH2n+2, где n – число атомов углерода.
Номенклатура
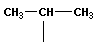
Общее (родовое) название предельных углеводородов — алканы. Названия первых четырех членов гомологического ряда метана тривиальные: метан, этан, пропан, бутан. Начиная с пятого названия образованы от греческих числительных с добавлением суффикса –ан (этим подчеркивается сходство всех предельных углеводородов с родоначальником этого ряда — метаном). Для простейших углеводородов изостроения сохраняются их несистематические названия: изобутан, изопентан, неопентад.
По рациональной номенклатуре алканы рассматривают как производные простейшего углеводорода — метана, в молекуле которого один или несколько водородных атомов замещены на радикалы. Эти заместители (радикалы) называют по старшинству (от менее сложных к более сложным). Если эти заместители одинаковые, то указывают их количество. В основу названия включают слово "метан":
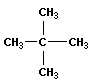
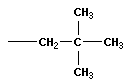
CH3 | H3C—C—CH3 | CH3 |
C2H5 | H3C—CH—CH—CH3 | CH3 |
тетраметилметан (2,2-диметилпропан) |
метилэтилизопропилметан (2,3-диметилпентан) |
Свою номенклатуру имеют и радикалы (углеводородные радикалы). Одновалентные радикалы называют алкилами и обозначают буквой R или Alk. Их общая формула CnH2n+ 1 . Названия радикалов составляют из названий соответствующих углеводородов заменой суффикса -ан на суффикс -ил (метан — метил, этан — этил, пропан — пропил и т.д.). Двухвалентные радикалы называют, заменяя суффикс -ан на -илиден (исключение - радикал метилен ==СН2). Трехвалентные радикалы имеют суффикс -илидин (исключение - радикал метин ==СН).
В таблице 1 приведены названия первых пяти углеводородов, их радикалов, возможных изомеров и соответствующие им формулы.
Таблица 1.
|
||||||||||||||||||||||||||||||||||||
Изомерия Изомеры – это вещества, имеющие одинаковый состав и одну и ту же молекулярную формулу и массу, но различное химическое строение, а потому обладающие различными физическими и химическими свойствами.
Структурная изомерия
Причиной проявления структурной изомерии в ряду алканов является способность атомов углерода образовывать цепи различного строения. Этот вид структурной изомерии называется изомерией углеродного скелета.
Структурные изомеры имеют одинаковый состав, но различаются химическим строением, при этом химические свойства изомеров - сходны, а физические - различны. Алканы с разветвленным строением из-за менее плотной упаковки молекул и, соответственно, меньших межмолекулярных взаимодействий, кипят при более низкой температуре, чем их неразветвленные изомеры.
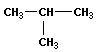
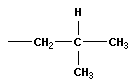
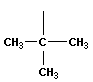
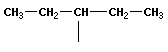
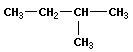
В молекулах метана СН4, этана С2Н6 и пропана С3Н8 может быть только один порядок соединения атомов, то есть первые три члена гомологического ряда алканов изомеров не имеют. Для бутана С4Н10 возможны две структуры: Один из этих изомеров (н-бутан) содержит неразветвленную углеродную цепь, а другой — изобутан — разветвленную (изостроение).
С увеличением числа атомов углерода в составе молекул увеличиваются возможности для разветвления цепи, т.е. количество изомеров растет с ростом числа углеродных атомов.
В ряду радикалов мы также встречаемся с явлением изомерии (см. табл. 1). Причем число изомеров у радикалов значительно больше, чем у соответствующих им алканов. Например, пропан, как известно, изомеров не имеет, а радикал пропил имеет два изомера: н-пропил и изо-пропил:
| СН3—СН3—СН2— и Н3С—СН—СН3
Химические свойства
Тривиальное (историческое) название алканов - "парафины" - означает "не имеющие сродства". Алканы химически малоактивны. Низкая реакционная способность алканов обусловлена очень малой полярностью связей С-С и С-Н в их молекулах вследствие почти одинаковой электроотрицательности атомов углерода и водорода. Предельные углеводороды в обычных условиях не взаимодействуют ни с концентрированными кислотами, ни со щелочами, ни даже с таким активным реагентом как перманганат калия.
Для них свойственны реакции замещения водородных атомов и расщепления.
В этих реакциях происходит гомолитическое расщепление кoвалентных связей, т. е. они осуществляются по свободно-радикальному (цепному) механизму. Реакции вследствие прочности связей C–C и C–H протекают или при нагревании, или на свету, или с применением катализаторов. Рассмотрим некоторые примеры реакций этого типа.
Галогенирование. Это одна из характерных реакций предельных углеводородов. Наибольшее практическое значение имеют бромирование и хлорирование алканов.
Нитрование. Несмотря на то, что в обычных условиях алканы не взаимодействуют с концентрированной азотной кислотой, при нагревании их до 140°С с разбавленной (10%-ной) азотной кислотой под давлением осуществляется реакция нитрования – замещение атома водорода нитрогруппой (реакция М.И.Коновалова). В подобную реакцию жидкофазного нитрования вступают все алканы, однако скорость реакции и выходы нитросоединений низкие. Наилучшие результаты наблюдаются с алканами, содержащими третичные углеродные атомы.
Крекинг. При высокой температуре в присутствии катализаторов предельные углеводороды подвергаются расщеплению, которое называется крекингом. При крекинге происходит гомолитический разрыв углерод-углеродных связей с образованием насыщенных и ненасыщенных углеводородов с более короткими цепями.
CH3–CH2–CH2–CH3(бутан) ––400°C> CH3–CH3(этан) + CH2=CH2(этилен) Повышение температуры процесса ведет к более глубоким распадам углеводородов и, в частности, к дегидрированию, т.е. к отщеплению водорода. Так, метан при 1500ºС приводит к ацетилену. 2CH4 ––1500°C> H–C=C–H(ацетилен) + 3H2
Изомеризация. Под влиянием катализаторов при нагревании углеводороды нормального строения подвергаются изомеризации - перестройке углеродного скелета с образованием алканов разветвленного строения.
CH3–CH2–CH2–CH2–CH3(пентан) ––t°,AlCl3> CH3–
CH–CH2–CH3(2- метилбутан) I CH3
Окисление. В обычных условиях алканы устойчивы к действию кислорода и окислителей. При поджигании на воздухе алканы горят, превращаясь в двуокись углерода и воду и выделяя большое количество тепла.
CH4 + 2O2 ––пламя> CO2 + 2H2O C5H12 + 8O2 ––пламя> 5CO2 + 6H2O
Билет №2.
№1.Строение атома. Электронные формулы атомов.
Атом — наименьшая частица вещества, неделимая химическим путем. В XX веке было выяснено сложное строение атома. Атомы состоят из положительно заряженного ядра и оболочки, образованной отрицательно заряженными электронами. Общий заряд свободного атома* равен нулю, так как заряды ядра и электронной оболочки уравновешивают друг друга. При этом величина заряда ядра равна номеру элемента в периодической таблице (атомному номеру) и равна общему числу электронов (заряд электрона равен −1).
Атомное ядро состоит из положительно заряженных протонов и нейтральных частиц — нейтронов, не имеющих заряда. Обобщенные характеристики элементарных частиц в составе атома можно представить в виде таблицы:
-
Название частицы
Обозначение
Заряд
Масса
протон
p
+1
1
нейтрон
n
0
1
электрон
e−
−1
принимается равной 0
Число протонов равно заряду ядра, следовательно, равно атомному номеру. Чтобы найти число нейтронов в атоме, нужно от атомной массы (складывающейся из масс протонов и нейтронов) отнять заряд ядра (число протонов).
Например, в атоме натрия 23Na число протонов p = 11, а число нейтронов n = 23 — 11 = 12
Число нейтронов в атомах одного и того же элемента может быть различным. Такие атомы называют изотопами.
Электронная оболочка атома также имеет сложное строение. Электроны располагаются на энергетических уровнях (электронных слоях).
Номер уровня характеризует энергию электрона. Связано это с тем, что элементарные частицы могут передавать и принимать энергию не сколь угодно малыми величинами, а определенными порциями — квáнтами. Чем выше уровень, тем большей энергией обладает электрон. Поскольку чем ниже энергия системы, тем она устойчивее (сравните низкую устойчивость камня на вершине горы, обладающего большой потенциальной энергией, и устойчивое положение того же камня внизу на равнине, когда его энергия значительно ниже), вначале заполняются уровни с низкой энергией электрона и только затем — высокие.
Максимальное число электронов, которое может вместить уровень, можно рассчитать по формуле: N = 2n2, где N — максимальное число электронов на уровне, n — номер уровня.
Тогда для первого уровня N = 2 · 12 = 2,
для второго N = 2 · 22 = 8 и т.д.
Число электронов на внешнем уровне для элементов главных (А) подгрупп равно номеру группы.
В большинстве современных периодических таблиц расположение электронов по уровням указано в клеточке с элементом. Очень важно понимать, что уровни читаются снизу вверх, что соответствует их энергии. Поэтому столбик цифр в клеточке с натрием : 1 8 2
следует читать так:на 1-м уровне — 2 электрона,на 2-м уровне — 8 электронов,на 3-м уровне — 1 электрон Будьте внимательны, очень распространенная ошибка!
Распределение электронов по уровням можно представить в виде схемы:
11Na ) ) ) 2 8 1
Если в периодической таблице не указано распределение электронов по уровням, можно руководствоваться:
максимальным количеством электронов: на 1-м уровне не больше 2 e−, на 2-м — 8 e−, на внешнем уровне — 8 e−;
числом электронов на внешнем уровне (для первых 20 элементов совпадает с номером группы)
Тогда для натрия ход рассуждений будет следующий:
2.Общее число электронов равно 11, следовательно, первый уровень заполнен и содержит 2 e−;
1.Третий, наружный уровень содержит 1 e− (I группа)
1.Второй уровень содержит остальные электроны: 11 − (2 + 1) = 8 (заполнен полностью)
* Ряд авторов для более четкого разграничения свободного атома и атома в составе соединения предлагают использовать термин «атом» только для обозначения свободного (нейтрального) атома, а для обозначения всех атомов, в том числе и в составе соединений, предлагают термин «атомные частицы». Время покажет, как сложится судьба этих терминов. С нашей точки зрения, атом по определению является частицей, следовательно, выражение «атомные частицы» можно рассматривать как тавтологию («масло масляное»).
№2.Непредельные углеводороды- алкены. Гомологический ряд, изомерия, номенклатура,хим.свойства.
Алке́ны — ациклические непредельные углеводороды, содержащие одну двойную связь между атомамиуглерода, образующие гомологический ряд с общей формулой CnH2n. Атомы углерода при двойной связи находятся в состоянии sp² гибридизации, и имеют валентный угол 120°. Простейшим алкеном является этилен (C2H4). По номенклатуре IUPAC названия алкенов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ен»; положение двойной связи указывается арабской цифрой.
Углеводородные радикалы, образованные от алкенов имеют суффикс «-енил». Тривиальные названия: CH2=CH— «винил», CH2=CH—CH2—«аллил».
Гомологический ряд алкенов
Алкенами называются углеводороды с двойной связью. Гомо-
логический ряд алкенов начинается этиленом (по номенклатуре
ИЮПАК— этеном):
CH2 CH2 C2H4 этилен (этен)
CH2 CH CH3 или C3H6 пропилен (пропен)
CH2 CH CH2 CH3 или C4H8 бутен-1
CH2 CH CH2 CH2 CH3 или C5H10 пентен-1
Номенклатура
По систематической номенклатуре названия алкенов строятся так, что в названии алкана, соответствующего этой родоначальной структуре, суффикс -ан заменяется на -ен. В случае раз-ветвления главной считается цепь, содержащая двойную связь, даже если эта цепь и не является самой длинной. Углеводородные радикалы, образованные из алкенов, имеют суффикс -енил. Некоторые радикалы имеют тривиальные названия, например винил (этенил), аллил (пропенил)