
- •Лабораторная работа № 1 определение отношения Ср/Сv
- •Параметры трех состояний газа представлены в таблице
- •Лабораторная работа №2 проверка газовых законов
- •Лабораторная работа № 3-а изучение фазовых переходов.
- •Лабораторная работа № 3-б изучение фазовых переходов
- •Лабораторная работа №4
- •Вопросы
- •1. Объяснение теплового расширения с точки зрения мкт.
- •3. Физический смысл коэффициента объемного и линейного расширения. Связь между ними.
- •5. Методика определения коэффициента линейного расширения.
- •Лабораторная работа № 5 определение удельной теплоемкости
- •Задание 2. Определение удельной теплоемкости жидкости методом электрокалориметра
- •Вопросы
- •Понятие теплоемкости тел. Удельная теплоемкость. Единицы измерения.
- •Молярная теплоемкость.
- •Классическая теория теплоемкости твердого тела. Закон Дюлонга и Пти, границы его применения.
- •Указания к лабораторной работе
- •Составить таблицу по результатам эксперимента:
- •Определение коэффициента внутренней теплопроводности песка
- •Задание
- •Лабораторная работа № 7-а определение коэффициента поверхностного натяжения
- •Смачиваемость, капиллярные явления.
- •Лабораторная работа №7-б определение коэффициента поверхностного натяжения.
- •Смачиваемость, капиллярные явления.
ВОПРОСЫ К ЛАБОРАТОРНЫМ РАБОТАМ
(техфак, информатика)
Лабораторная работа №1
1. 1 начало термодинамики. Внутренняя энергия, работа газа, теплота. Их определение. Степени свободы молекул.
2. Понятие удельной и молярной теплоемкости. Единицы измерения.
3. Уравнение Майера. Выражение СP и СV через число степеней свободы молекул. Почему CP > CV ?
4. Классическая теория теплоемкости газов. График зависимости теплоемкости от температуры. Его объяснение.
5. Адиабатный процесс. Уравнение адиабаты. Уравнение Пуассона. График адиабатного процесса.
Лабораторная работа №2
1. Микро- и макропараметры, характеризующие состояние газа. Их физический смысл.
2. Изопроцессы. Законы и уравнения их определяющие (Бойля-Мариотта, Гей-Люссака, Шарля). Графики изопроцессов в координатах р и V, р и t0 ,V t0. Закон Авогадро.
3. Вывод уравнения Клапейрона-Менделеева из основного уравнения МКТ газов.
4. Термический коэффициент давления, коэффициент объемного расширения газов.
5. Объяснение газовых законов с точки зрения МКТ газов. Вывод изозаконов из уравнения Клапейрона-Менделеева.
6. Физический смысл универсальной газовой постоянной.
7. Закон Дальтона.
8. Ход работы, объяснение всех этапов, результаты, выводы, погрешности.
Лабораторная работа №3 (а,б)
1. Изменение агрегатных состояний (плавление-отвердевание, испарение-конденсация). Объяснение этих процессов с точки зрения МКТ.
2. Уравнение теплового баланса для процессов нагревания и плавления, нагревания и кипения.
3. Понятия “удельная теплоемкость”, “удельная теплота плавления”, “удельная теплота парообразования”. Единицы измерения.
4. Графики плавления кристаллических и аморфных тел и их объяснение.
5. Зависимость температуры фазового перехода от давления.
6. Диаграмма состояния. Тройная точка.
7. Полиморфизм.
8. Ход работы.
Лабораторная работа №4
1. Объяснение теплового расширения с точки зрения МКТ.
2. Зависимость линейных и объемных размеров твердого тела и жидкости от температуры.
3. Физический смысл коэффициента объемного и линейного расширения. Связь между ними.
4. Что такое плотность ? Единицы измерения. Зависимость плотности вещества от температуры.
5. Методика определения коэффициента линейного расширения.
Лабораторная работа № 5
1. Понятие теплоемкости тел. Удельная теплоемкость. Единицы измерения.
2. Что такое грамм-атом, килограмм-атом, грамм-моль, киломоль вещества ? Закон Авогадро.
3. Число степеней свободы молекулы твердого тела. Внутренняя энергия 1 кмоль твердого тела.
4. Молярная теплоемкость.
5. Классическая теория теплоемкости твердого тела. Закон Дюлонга и Пти, границы его применения.
6. Температурная зависимость теплоемкости.
Лабораторная работа №7 (а,б)
1. Строение жидкости с точки зрения МКТ.
2. Поверхностный слой, силы поверхностного натяжения, энергия поверхностного слоя. Коэффициент поверхностного натяжения.
3. Давление под искривленной поверхностью, формула Лапласа.
4. Смачиваемость, капиллярные явления.
5. Методы определения поверхностного натяжения.
Лабораторная работа № 1 определение отношения Ср/Сv
Определение отношения теплоемкостей воздуха Ср/Сv методом адиабатического расширения.
Оборудование: толстостенный стеклянный сосуд, жидкостный манометр, насос Шинца, трехходовой кран.
Сущность метода: определение = Ср/Сv основано на адиабатическом расширении газа.
В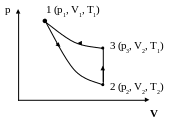 баллон насосом подкачивают воздух,
создавая давление выше атмосферного.
Газ характеризуется параметрами V1,
Р1, Т1 (на графике точка 1).
Быстро открыв и закрыв кран, соединяющий
баллон с окружающей средой, получим
адиабатическое расширение воздуха. Газ
перейдет в новое состояние, характеризуемое
параметрами V2, Р2, Т2
(на графике точка 2). Причем Т2>Т1
.Через несколько минут газ нагреется
до температуры окружающего воздуха
(Т1), при этом при V2 = соnst
давление повысится до Р3. Новое
состояние газа будет характеризоваться
параметрами Р3, V2, Т1
(на графике точка 3).
баллон насосом подкачивают воздух,
создавая давление выше атмосферного.
Газ характеризуется параметрами V1,
Р1, Т1 (на графике точка 1).
Быстро открыв и закрыв кран, соединяющий
баллон с окружающей средой, получим
адиабатическое расширение воздуха. Газ
перейдет в новое состояние, характеризуемое
параметрами V2, Р2, Т2
(на графике точка 2). Причем Т2>Т1
.Через несколько минут газ нагреется
до температуры окружающего воздуха
(Т1), при этом при V2 = соnst
давление повысится до Р3. Новое
состояние газа будет характеризоваться
параметрами Р3, V2, Т1
(на графике точка 3).
Параметры трех состояний газа представлены в таблице
Порядковый номер состояния газа |
Условия опыта |
Объем |
Давление |
Температура |
1 |
До открытия крана |
V1 |
P1 = P2 + h1 |
T1 |
2 |
В момент открытия крана |
V2 |
P2 |
T2 |
3 |
После закрытия крана |
V2 |
P3 = P2 + h2 |
T1 |
Можно сравнивать начальное (1) и конечное (2) состояния газа и использовать закон Бойля и Мариотта, или можно сравнивать 2 и 3 состояния газа при V2 -соnst и использовать закон Шарля:
![]()
К процессу перехода газа из 1 состояния во 2 (адиабатическое расширение) применимо уравнение адиабаты (закон Пуассона)

В ходе эксперимента необходимо измерить разность уровней жидкости в манометре.
В первом состоянии:
h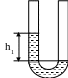 1
- разность уровней до расширения воздуха.
1
- разность уровней до расширения воздуха.
Р1 = Р2 + h1 ,
где Р2 - атмосферное давление.
В третьем состоянии:
h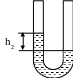 2
- разность уровней после расширения
воздуха.
2
- разность уровней после расширения
воздуха.
Р3 = Р2 + h2 ; h2 = Р3 - Р2
Получим расчетную формулу:

Разложим данные выражения по биному Ньютона и ограничимся членами первого порядка
![]()
![]()
Задание 1
1. Трехходовой кран устанавливают так, чтобы баллон соединялся с насосом и манометром, а доступ с атмосферой был перекрыт. Осторожно накачивают воздух, чтобы разность уровней жидкости в манометре составлял не менее 20 см.
2. Закрывают кран так, чтобы, перекрыв связь с насосом, баллон был соединен только с манометром, и через 2-3 минуты после прекращения изменения уровней жидкости отсчитывают h1.
3. Резко открывают и закрывают кран, соединяющий баллон с атмосферой. Через 2-3 минуты после прекращения изменения уровней жидкости в манометре отсчитывают h2.
4. Проделывают не менее 10 измерений.
5. Рассчитывают ошибку результатов измерений
№, п/п |
h1, м |
h2, м |
|
СР |
|
СР |
, % |
|
|
|
|
|
|
|
|
Можно ли обосновать правильность полученного экспериментального результата ?
Проведем теоретический расчет .
Удельной теплоемкостью с называется теплоемкость единицы массы однородного вещества.
![]() ,
,
где С - теплоемкость,
М - масса тела.
Если теплоемкость относят к одному молю (m/) вещества, то ее называют молярной.
Теплоемкостью С тела называется отношение элементарного количества теплоты Q , сообщенного телу в каком-либо процессе к соответствующему изменению температуры тела:
![]() .
.
Теплоемкость зависит от массы тела, его химического состава, термодинамического состояния и вида процесса сообщения теплоты.
Проведем рассуждения для одного моля газа.
Газ можно нагревать при постоянном объеме (молярная теплоемкость при постоянном объеме СV ) или при постоянном давлении (молярная теплоемкость при постоянном давлении СP). Воспользуемся первым законом термодинамики:
Q = U + А
1) При нагревании газа при V = соnst все количество теплоты идет только на увеличение внутренней энергии газа
Q = U ; СV Т = U ; СV = U / Т
2) При нагревании газа при Р = соnst , кроме теплоты, идущей на повышение внутренней энергии газа, необходимо еще тепло для совершения работы расширения газа ( А = РV ).
СPТ = U + РV = U + RТ
![]() - ( уравнение
Майера )
- ( уравнение
Майера )
Исходя из
представления молекулярно-кинетической
теории газов внутренняя энергия одного
моля газа распределяется в среднем
поровну между всеми степенями свободы
молекулы
![]() ,
тогда молярная теплоемкость при
постоянном объеме будет равна,
,
тогда молярная теплоемкость при
постоянном объеме будет равна,
![]() ,
а молярная теплоемкость при постоянном
давлении
,
а молярная теплоемкость при постоянном
давлении
![]()
Одноатомному газу приписывают 3 (i = 3) степени свободы, двухатомному - 5 (i = 5), а многоатомному (например, воздух) - 6.
Тогда: = CP / CV = 7 / 5 = 1,40
Дополнительные сведения к методике эксперимента по способу Клемана и Дезорма.
1. В начале в сосуде давление воздуха соответствовало атмосферному давлению. В результате накачивания небольшой порции воздуха давление увеличивается. Так как, сжатие воздуха адиабатическое, то его температура повысилась. Разность уровней в манометре (h1) установится только тогда, когда в результате теплопроводности стеклянных стенок сосуда температура воздуха в сосуде сравняется с температурой окружающего воздуха. Поэтому, после нагнетания воздуха необходимо подождать пока установится постоянная разность высот h1.
Параметры первого состояния: Р1 = Р2 + h1 ; V1 ; Т1 .
2. Следующим этапом эксперимента является быстрое открытие крана. При этом воздух начнет адиабатически расширяться, пока давление его не станет равным атмосферному. Газ совершает работу за счет изменения его внутренней энергии (воспользуйтесь первым законом термодинамики, определением адиабатического процесса и объясните данный факт), поэтому температура воздуха понижается до Т2.
Параметры второго состояния: Р2 ; V2 ; Т2 , причем V2 > V1, т.к. масса m занимает весь объем сосуда.
3. Закрываем кран. Давление возрастает, потому что воздух в сосуде начинает нагреваться за счет притока тепла извне. Когда Т2 = Т1, рост давления прекращается.
Параметры третьего состояния: Р3 = Р2 + h2 ; V2 ; Т1.
2 способ. Определение по скорости звука в газе.
Оборудование: осциллограф, трубка (ℓ = 0,63 м) с телефонами, звуковой генератор, барометр-анероид, жидкостный термометр.
Сущность метода: В трубке с воздухом возбуждаются колебания звуковой частоты. Амплитуда колебаний будет максимальной, если добиться наступления акустического резонанса. Резонанс наступит, когда в трубке будет укладываться целое число полуволн бегущей звуковой волны или целое число длин волн стоячих звуковых волн.
 ℓ = (
/ 2)n
ℓ = (
/ 2)n
n - число длин полуволн
Получим расчетную формулу:
Скорость звука, плотность газа и его давление связаны соотношением:
![]() , где
= СP
/ CV
, где
= СP
/ CV
![]()
1) Плотность воздуха определим из уравнения Менделеева-Клапейрона
= 2910-3 кг/моль ; R = 8,31 Дж/(мольК)
2) Давление определим по показаниям барометра-анероида.
3) ; ℓ n
Число n определим из двух последовательных резонансных состояний системы, при которых устанавливаются стоячие волны.
![]()
Тогда отношение СP/СV будет равно:
![]()
Добейтесь на экране осциллографа колебаний достаточной амплитуды. Плавно изменяя частоту подаваемого сигнала, по всплескам амплитуды колебаний на экране, зафиксируйте моменты наступления резонанса. Запишите резонансные частоты и для каждой подсчитайте скорость звука.
Рассчитайте ошибку результата измерения и сравните значения отношения СP/СV , полученные разными способами.
ВОПРОСЫ.
Что называют внутренней энергией? Количеством теплоты?
Определение и математическое выражение теплоемкости тела, удельной теплоемкости вещества, молярной теплоемкости вещества.
Почему для газов различают теплоемкость при постоянном объеме (СV) и теплоемкость при постоянном давлении (СР) ?
Дать определение молярных теплоемкостей при постоянном объеме и постоянном давлении, объяснить соотношение между ними (уравнение Майера).
Дать понятие о степени свободы; выразить СР и СV через число степеней свободы.
Адиабатный процесс. Уравнение Пуассона, график адиабатного процесса.
Определение СР / СV методом адиабатного расширения (ход работы).
Что называется волной? Как образуется стоячая волна, ее особенности.
Что называется длиной волны?
Что такое резонанс? Условие наступления резонанса в трубе с воздухом.
Что называется скоростью звука? Плотностью (газа), давлением? Соотношение между ними.
Вывод расчетной формулы для . Методика эксперимента по определению .
