
- •Методические указания к лабораторным работам по дисциплине «Аналитическая химия»
- •Введение
- •Качественный химический анализ Краткие теоретические сведения
- •Лабораторная работа №1. Действие групповых реагентов
- •Лабораторная работа №2. Качественные аналитические реакции катионов
- •Первая аналитическая группа катионов
- •Вторая аналитическая группа катионов
- •Третья аналитическая группа катионов
- •Четвертая аналитическая группа катионов
- •Пятая аналитическая группа катионов
- •Шестая аналитическая группа катионов
- •Разделение ионов по аналитическим группам и внутри группы (полезная информация для выполнения лаб. Работ со 3 по 5) Катионы I и II аналитических групп.
- •Катионы III и IV аналитических групп.
- •Катионы V и VI аналитических групп
- •Лабораторная работа № 3. Анализ смеси катионов I и II аналитических групп
- •Лабораторная работа № 4. Анализ смеси катионов третьей и четвертой аналитических групп
- •Лабораторная работа № 5. Анализ смеси катионов пятой и шестой аналитических групп
- •Количественный химический анализ
- •Лабораторная работа № 6. Определение содержания соды в присутствии щёлочи
- •Лабораторная работа № 7. Окислительно-восстановительное титрование
- •Йодометрическое определение содержания меди
- •Лабораторная работа № 8. Комплексонометрическое титрование Определение содержания кальция и магния в совместном присутствии
- •Физико-химические методы количественного анализа Краткие теоретические сведения Фотометрический анализ в видимой области света
- •Кондуктометрический анализ
- •Потенциометрический анализ
- •Лабораторная работа № 9. Фотометрическое определение содержания железа
- •Оборудование и реактивы.
- •Выполнение работы
- •I. Приготовление рабочего раствора соли железа.
- •II. Получение градуировочной зависимости
- •III. Проведение анализа пробы
- •Протокол лабораторной работы
- •Обработка результатов эксперимента
- •Лабораторная работа № 10. Фотометрическое определение никеля с диметилглиоксимом
- •Оборудование и реактивы
- •Выполнение работы
- •I. Приготовление рабочего раствора соли никеля
- •II. Получение градуировочной зависимости
- •III. Проведение анализа пробы
- •Протокол лабораторной работы
- •Обработка результатов эксперимента
- •Лабораторная работа № 11. Кондуктометрическое кислотно-основное титрование
- •Обработка экспериментальных данных
- •Лабораторная работа № 12. Кондуктометрическое определение хлорид-иона в пробе раствора методом прямой кондуктометрии
- •Выполнение работы
- •Протокол лабораторной работы
- •Обработка результатов эксперимента
- •Лабораторная работа № 13. Определение хлорид-иона методом потенциометрического титрования
- •Выполнение работы
- •Обработка результатов эксперимента
- •Лабораторная работа № 14. Определение концентрации ионов ионометрическим методом
- •Выполнение работы
- •I. Приготовить серию контрольных растворов с содержанием определяемого иона 101, 102, 103, 104 моль/кг методом последовательного разведения.
- •II. Получить градуировочную зависимость и измерить эдс пробы при помощи ионоселективного электрода.
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Содержание
II. Получение градуировочной зависимости
1) в мерные колбы объемом 50 мл № 1 – 6 градуированной пипеткой объемом 10 мл отобрать 0 −2 – 4 – 6 – 8 – 10 мл рабочего раствора соли никеля;
2) в каждую колбу прилить по 5 мл ниже перечисленных растворов строго в указанной последовательности:
а) сегнетова соль,
б) гидроксид натрия,
в) персульфат аммония,
г) диметилглиоксим;
3) спустя 2 – 3 минуты объем каждой колбы довести дистиллированной водой до метки и тщательно перемешать;
В мерной колбе № 1 получится практически бесцветный раствор сравнения, относительно которого фотометрируют окрашенные растворы. Раствор сравнения оставить для проведения анализа пробы.
4) через 5 – 7 минут измерить оптическую плотность раствора при длине волны 470 нм, начиная с самого разбавленного (наименее окрашенного):
а) в кювету толщиной 1 см налить до метки раствор сравнения и насухо протереть стенки кюветы салфеткой;
б) кювету с раствором сравнения поместить в дальнее отделение кюветодержателя;
в) в другую кювету толщиной 1 см налить до метки окрашенный раствор и насухо протереть стенки кюветы кусочком фильтровальной бумаги;
г) кювету с окрашенным раствором поместить в ближнее отделение кюветодержателя;
д) кюветодержатель поместить в кюветное отделение прибора;
е) измерить оптическую плотность, следуя инструкции к пользованию прибором.
7. Результаты измерений занести в таблицу № 4.
III. Проведение анализа пробы
1. В мерную колбу объемом 50 мл № 7 отобрать мерной пипеткой 5 мл исследуемого раствора.
2. Прилить по 5 мл ниже перечисленных растворов строго в указанной последовательности:
а) сегнетова соль,
б) гидроксид натрия,
в) персульфат аммония,
г) диметилглиоксим.
3. Спустя 2 – 3 минуты объем колбы довести дистиллированной водой до метки и тщательно перемешать.
4. Через 5 – 7 минут измерить оптическую плотность приготовленного раствора при длине волны470 нм по отношению к раствору сравнения (колба № 1).
5. Результаты эксперимента занести в таблицу № 1.
Протокол лабораторной работы
1. Концентрация стандартного раствора соли никеля
Сст.(Ni2+) = _______________ г/л;
2. Объем стандартного раствора соли железа, использованный для приготовления рабочего раствора соли железа
Vст.(Ni3+) = …………….мл
3. Объем приготовленного рабочего раствора соли никеля (III) Vраб. = …………мл
4. Объем пробы исследуемого раствора, взятый для анализа Va = ………..мл
Таблица 4.
Зависимость оптической плотности раствора от объема рабочего раствора соли железа
№ колбы |
2 |
3 |
4 |
5 |
6 |
7 |
V(Ni2+), мл |
2 |
4 |
6 |
8 |
10 |
проба |
D(Ni) |
|
|
|
|
|
|
Обработка результатов эксперимента
1. Вычислить концентрацию рабочего раствора соли никеля:
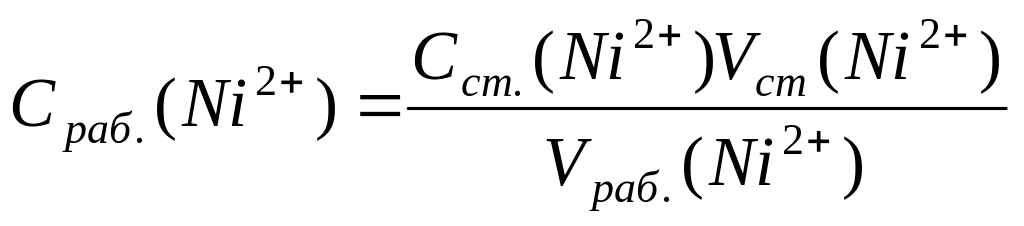 ,
г/л.
,
г/л.
2. По данным таблицы 4 заполнить таблицу 5
Таблица 5.
Данные для построения градуировочной зависимости
№ колбы |
2 |
3 |
4 |
5 |
6 |
Vраб.(Ni2+), мл |
2 |
4 |
6 |
8 |
10 |
D(Ni) |
|
|
|
|
|
m(Ni), мг |
|
|
|
|
|
3. По данным таблицы 5 построить градуировочную зависимость в координатах D – m(Ni) (см. рис. 5).
4. По градуировочному графику определить массу никеля в пробе (см. рис. 5).
5. Рассчитать концентрацию железа в пробе раствора:
![]() .
(11)
.
(11)
Рис. 5. Определение массы никеля (II) в пробе раствора по градуировочной зависимости
