
- •Методичні вказівки
- •6.091602 – Хімічна технологія неорганічних речовин:
- •1. Основи горіння палива
- •1.1 Основні залежності, формули та рівняння
- •2.2 Приклади розрахунків
- •2. Перший закон термодинаміки і газові процеси
- •2.1 Основні залежності, формули та рівняння
- •2.2 Приклади розрахунків
- •3. Другий закон термодинаміки
- •4. Максимально-корисна робота
- •4.1 Основні залежності та розрахункові формули
- •4.2 Приклади розрахунків
- •5. Газові закони та їх застосування при розрахунках
- •5.1. Основні залежності та розрахункові формули
- •6.2. Приклади розрахунків.
- •Розв' язок.
- •Розв'язок
- •Розв'язок
- •Розв' язок
- •6. Графічні методи рішення задач
- •6.1. Приклади розрахунків
- •Розв'язок
- •Розв'язок
- •7. Розрахунок ексергії систем. Визначення втрат ексергії
- •7.1. Основні залежності і розрахункові формули
- •7.2. Приклади розрахунків.
- •Розв' язок.
- •8. Розрахунки ексергії горіння палива. Визначення термічного та ексергетичного коефіцієнта корисної дії
- •8.1. Приклади розрахунків.
- •8.1.1 Розрахунок ексергії вихідного палива.
- •8.1.2 Розрахунок матеріального балансу процесу горіння палива.
- •8.1.3 Розрахунок теплового коефіцієнта корисної дії
- •8.1.4. Розрахунок ексергетичного коефіцієнта корисної дії процесу горіння палива.
- •Перелік літературних посилань
- •51918 М. Дніпродзержинськ
2. Перший закон термодинаміки і газові процеси
2.1 Основні залежності, формули та рівняння
Перший закон термодинаміки в математичному виді можливо виразити так: все підведене тепло до газу в процесі витрачається на зміну внутрішньої енергії і на удосконалення роботи.
Рівняння першого термодинаміки застосовується в двох видах:
Перший вид:
dq = dU + A·P·Dv
q
=
![]() U
+ A·L
U
+ A·L
(2.1)
де:
U - зміна внутрішньої енергії газу при Ср = const
L - робота процесу, кДж\кг
Другий вид:
dq = J - А·V·dР
q
=
j
– А
![]() V·dР
=
J
+ A·L0
V·dР
=
J
+ A·L0
(2.2)
де
VJ - зміна ентальпії газу при Cр= const
Lo - робота, кДж/кг .Ентальпія і внутрішня енергія мають слідуючий взаємозв'язок:
J=U + A.P. V (2.3)
де
Р - тиск газу, Па
V - питомий об’єм газу, м3\кг
Ізобаричний процес:
В ізобаричному процесі тепло, надане газу, іде на збільшення його ентальпії:
q-Aj-Bp(t2-t1)
Робота з ізобарному процесі визначається по формулі:
L = Р (V2 – V1)
Ізохорний процес:
Тепло, яке надане газу, іде на збільшення його внутрішньої енергії
q
=
![]() U
= СV·(t2
– t1) (2.4)
U
= СV·(t2
– t1) (2.4)
Робота з ізохорному процесі
L=0
Ізотермічний процес:
В цьому процесі тиск газу зворотно пропорціональний його об’ємам:
P2/P1=V1/V2
Тепло, надане ідеальному газу, іде на виконання роботи:
q = AL = AP1V1 LnV2/V1
Зміна знутрішньої енергії і ентальпії дорівнюють нулю
Робота визначається по формулі:
L =
Р1V1Ln![]() = Р1V1Ln
= Р1V1Ln![]()
Адіабатний процес:
Для адіабатних процесів dq = 0. Робота газу складає:
L =
![]() ·(Р1V1
– Р2V2)
=
·(Р1V1
– Р2V2)
=
![]() ·(Т1
– Т2)
=
·(Т1
– Т2)
=
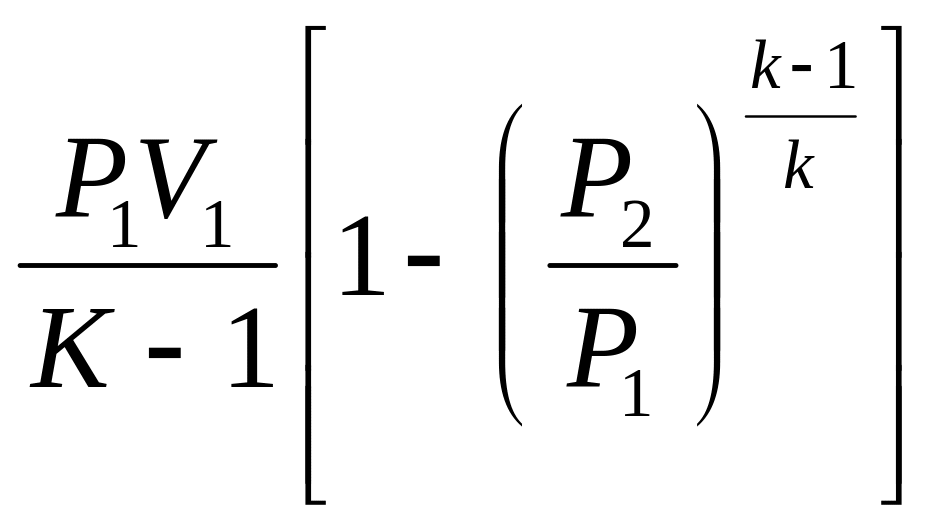 =
=
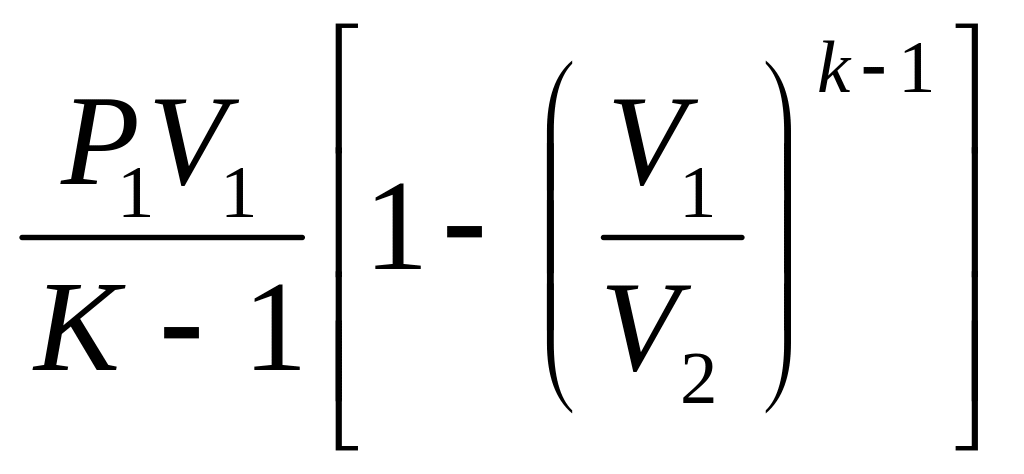
В адіабатному процесі робота впроваджується за рахунок зменшення внутрішньої енергії газу:
L =
![]() ·(U
- U) =
·СV·(t1
– t2)
·(U
- U) =
·СV·(t1
– t2)
Політропний процес:
Роботу газу в політропному процесі визначають по формулі:
L =
![]() ·(Р1V1
– Р2V2)
·(Р1V1
– Р2V2)
або
L =
![]() ·(Т1
– Т2)
·(Т1
– Т2)
L =

Зміна внутрішньої енергії газу і тепло з політропному процесі знаходиться по формулі:
U = U2 – U1 = СV·(t2 – t1)
q
= СV
-
![]() ·(t2
– t1)
·(t2
– t1)
Показник політропи
n =
![]() . . . mа . . . n =
. . . mа . . . n =
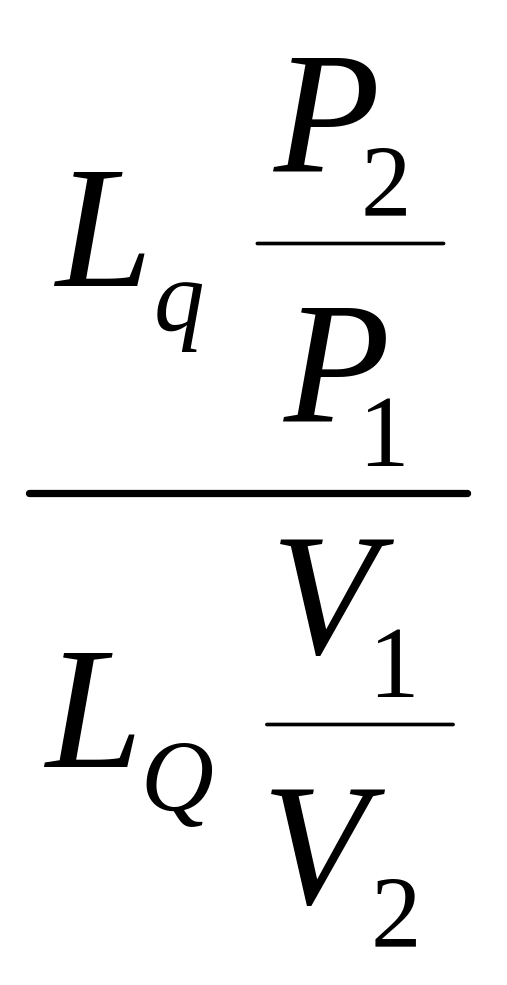
2.2 Приклади розрахунків
Приклад 1
Визначити об’єм балону для стиснення азоту та його вагу, якщо об’єм посудини з горючим - VR= 0.25 м3 ,а об’єм посудини для окислення V0 = 0.5 м3. Тиск подачі компонентів Рк = 2.0 мПа, тиск азоту в балоні Р0 =30мПа і температура - 30°С. Вирішення
1. Процес - ізотермічний. Рівняння ізотерми PV = const для даної задачі буде мати вигляд:
Pn2·Vn2 = Pк(Vr+V0+VN2)
Після підстановки величин і відповідної перебудови рівняння одержимо:
15 = 0,75 + Vn2
звідки
VN2 =0,75/14= 0.0536л3
Таким чином, об’єм балону для стиснення азоту складає 0.0536 м3
2. Вагу стисненого азоту (в кг) визначимо із рівняння стану для G кг речовини, яке для прийнятих відзначень буде мати вигляд:
РN2·VN2 = GN2·RN2·ТN2
звідки
GN2
=

RN2 - газова постійна для азоту;
RN2
=
![]()
RN2
=
![]() = 30,3 кг.м/кг.град.
= 30,3 кг.м/кг.град.
Rm - універсальна газова постійна, яка дорівнєю 848;
МН2- молекулярна вага азоту, М = 28;
Т - абсолютна температура азоту
GN2
=
![]() = 18,1 кг
= 18,1 кг
Визначемо масу стисненого азоту (та) в системі СІ Рівняння стану для m кг речовини має вигляд:
РN2V = mRT
де
Раб - абсолютний тиск, н\м2 .
V- об’єм м3
m - маса, кг
Т - абсолютна температура, К
R - газова постійна, яка має розмірність
R =
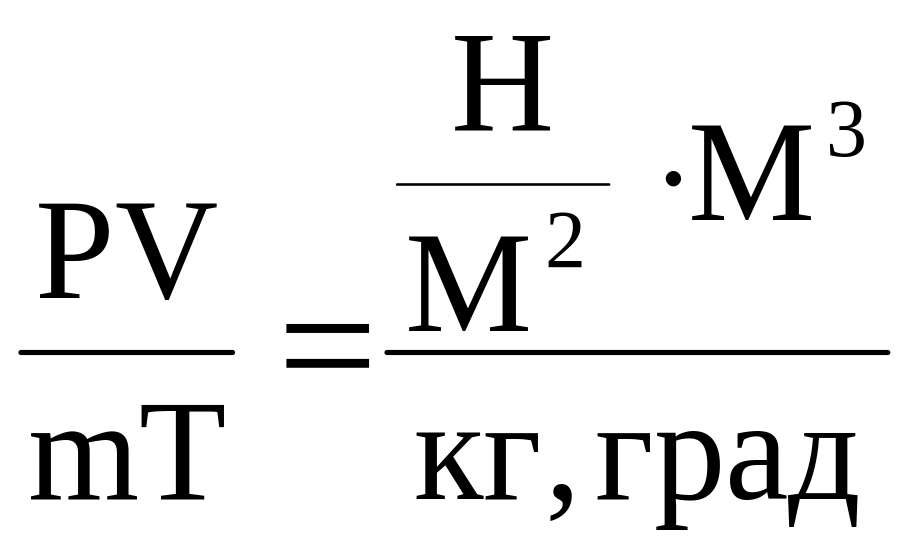
або
R
=
![]()
Залишимо для данної задачі:
РN2VA=mN2.RN2.TN2
де
Ra- газова постійна азоту,
ТN2=20+ 173= 193 К
Газову постійну RN2 визначимо із рівняння
RN2
=
![]()
де R - універсальна газова постійна
R = 848. 9,81 = 8.32.103 Дж/кмольград
МN2=28, тоді
RN2 =8,31/28=0,297·103Дж/кмольград
Визначаємо масу стисненого азоту
mа
=
![]() ; mа
=
; mа
=
![]() = 18,1 кг
= 18,1 кг
В системі СІ Ра дорівнює:
Ра = 300 кг/см3= 300.104 кг\м2. 9.81 = 294.3.105 н\м2
Приклад 2
Ізотермічно стискують 1000 м3 азоту від 100 до 500 кн\м2Температура азоту 127°С
Підрахувати:
а) об’єм азоту після стиснення;
б) роботу, що витрачена на стиснення;
в) кількість тепла, що виділяється.
Розв’язок
1. Визначимо об’єм азоту після стиснення:
V2
=
![]() ; V2
=
; V2
=
![]() м³
м³
2. Робота стиснення визначається по формулі:
А = 19.
1. п. Т. Ld·![]()
де п - кількість азоту, яка визначається по формулі:
Тоді
n =
![]() n
=
n
=
![]() = 30,0 кмоль
= 30,0 кмоль
А =
191,1·30·400·Lg·![]() = - 168 кДж
= - 168 кДж
3. Кількість тепла, яке зиділяється системою буде 168 мДж
Приклад З
Визначити показник політропи, кількість відведеного тепла, середню теплоємність процесу, зміну внутрішньої енергії і витрачену роботу, якщо в результаті стиснення 24 м3 повітря від Рі = 2 атм або 0.098 мПа до Р2 = 10 атм або 0.98 мПа, об’єм його зріс в 6 раз. Газова постійна для повітря R = 29.3 кг.м\кг.град, показник адіабати - К= 1.41, теплоємність повітря Ср = 0.24 ккал\кг.град. І Cv= 0/17 ккал\кг .град.
Рішення
Показник політропи стиснення визначається по формулі:
n =

Підставляємо числові значення, одержуємо:
n =
![]() =
=
![]() = 1,29
= 1,29
Витрачена на стиснення повітря робота дорівнює:
L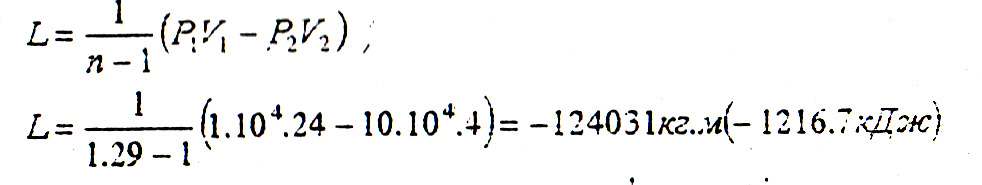 =
·(Р1V1
– Р2V2)
=
·(Р1V1
– Р2V2)
L =
![]() ·(1·104·24
– 10·104·4)
= - 124031кг.м (-1216,7 кДж)
·(1·104·24
– 10·104·4)
= - 124031кг.м (-1216,7 кДж)
Кількість підведеного тепла визначається по формулі:
q = U + АL
![]() =
=
![]() =
=
 =
=
![]() = х =
= х =
![]() = - 2,42
= - 2,42
q
=
![]() q
=
q
=
![]() = - 368 кДж
= - 368 кДж
4. Зміна внутрішньої енергії розраховується по формулі:
U = q - АL
U
= - 88,0 +
![]() = 202 ккал = 846 кДж
= 202 ккал = 846 кДж
Середня теплоємність процесу дорівнює:
С =
СV·![]() = 0,17·
= 0,17·![]() = - 0,082 ккал/кг.град
= - 0,082 ккал/кг.град
або С = - 0,343 кДж\кг.град
Приклад 4
В автоклаві знаходиться 20 дм3 водню під тиском 120 кн\м2 і температурі 17°С. При нагріванні автоклава тиск в ньому підвищується до
600 кн\м2 Підрахувати:
а) скільки тепла підведено водню, в автоклаві, якщо мольна теплоємність його при постійному об’ємі складає Cv = 20.93 Дж\моль;
б) де якої температури нагрівається водень?
Розв'язок
1. Визначаємо кількість тепла, яке отримує водень по формулі:
V = cоnst – ізохорний процес
q = n·СV·(t2 – t1)
q
= n·![]() ·(Р2
– Р1)
·(Р2
– Р1)
де
п - число молей водню:
Р1Т1 - початковий стан газу;
Р2Т2- кінцевий стан газу
2. Розрахуємо кількість водню:
n =
![]() =
=
![]() = 1,02·10-3
кмоль
= 1,02·10-3
кмоль
q
=
![]() ·(600
- 120) = 24,3 кДж
·(600
- 120) = 24,3 кДж
3, Визначаємо температуру водню після нагрівання:
q = n·СV·(t2 – t1)
24,8 = 1,02·10-3·20.93·(Т2 - 290)
Т2 = 1450 К або 1177 °С
Приклад 5
В циліндрі з поршнем знаходиться повітря, його тиск 4 ат, температура - г= 500°С Від повітря віднімається тепло таким чином, що в кінці процесу установлюється температура 100°С. Об’єм циліндра, в якому знаходиться повітря, 200 л
Визначити кількість відведеного тепла, кінцевий об’єм, зміну внутрішньої енергії та звершену над газом роботу стиснення.
Рішення
Кількість віднятого тепла визначається по рівнянню:
qg
=
VН·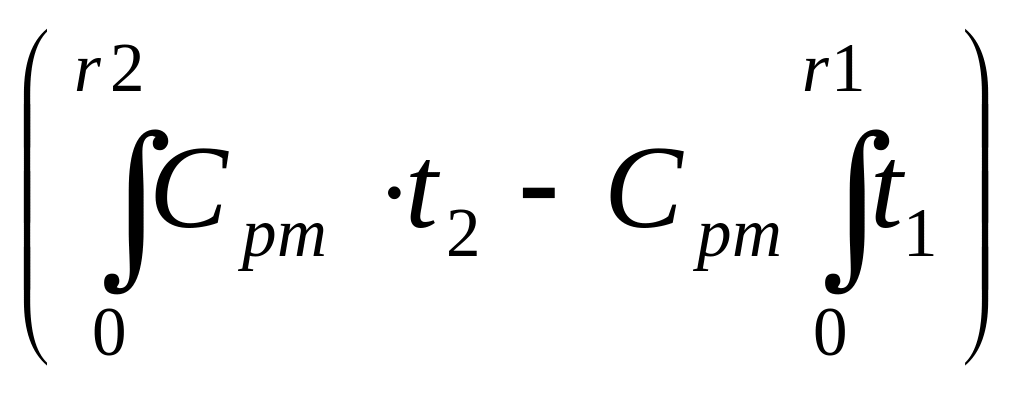
а) Об’єм газу відносимо до нормальних умов по формулі:
VН
=
![]() =
=
![]() = 0,342 м³
= 0,342 м³
б) знаходимо значення середньої теплоємності повітря по табл. 1 -7 \ \ для t1=500 і t2 = 100 °С
Срм = 1.2866 + 0.0001201 (100 + 500) = 1.368 кДж\м3 град.
Підставляємо знайдені значення в формулі для визначення кількості тепла:
QB= 0.342 . 1.368 (100 - 500) = - 186 кДж
2. Кінцевий об’єм визначається по закону Гей-Люсака:
V2
= V1·![]() ; V2
=
; V2
=
![]() м³
м³
3. Зміна внутрішньої енергії:
U = VН·Ср·(t2 – t1)
U = 0,342·(0,9157 + 0,0001201·600)·х·(100 - 500) = - 135,4 кДж
або на основі формули:
qV = UV = (U2 – U1)
тобто це рівняння першого закону термодинаміки при V=const розраховуємо зміну внутрішньої енергії, користуючись таблицями додатку:
UV = 0,342·(345 – 738) = - 135 кДж;
![]() = U2·βН
= 266·71,293 = 345 кДж/м³;
= U2·βН
= 266·71,293 = 345 кДж/м³;
![]() = U1·βН
= 570:5·1,293 = 738 кДж/м³;
= U1·βН
= 570:5·1,293 = 738 кДж/м³;
Значення U2 і Ui для температур t2 = 100°С і t1 = 500°С взяті із додатку
4. Робота, яка створена над газом, дорівнює:
Q = P(V2-V1)
Q = 5. 0,0981.106 (0.0966 - 0.2) = - 50.6 кДж
Перевірка по рівнянню першого закону термодинаміки:
QB= YU + W; - 186 = - 135.4-50.6 = - 186 кДж
та аргону SN2 = 0,37; SAr = 0,63. Гази ідеальні. Ентропія азоту та аргону дорівнює нулю при параметрах Р2 — 1 кг/см"; t = 0 °С. Використовують табл. 8.
Ентропія суміші дорівнює сумі ентропій газів та ентропії зміщення,
1. Ентропія 0,37 кг азоту на 1 кг суміші визначається по формулі:
SN2
= (S2
- S1
– R·ln![]() )·qN2
)·qN2
SN2
= (0,1854 - 0 -
![]() ·2,3·lq3)·0,37
= 0,0398·4,2 = 0,167 кДж/кг·град
·2,3·lq3)·0,37
= 0,0398·4,2 = 0,167 кДж/кг·град
2. Ентропія 0,63 кг/кг суміші аргону дорівнює:
SАr
= (Ср·ln![]() – R·ln
)·qАr
– R·ln
)·qАr
SАr
= (![]() ·lq
·lq![]() -
-
![]() ·lq3)·0,63·2,3
= 0,0236 ккал/кг·град =
·lq3)·0,63·2,3
= 0,0236 ккал/кг·град =
= 0,099 кДж/кг·град
3.Ентропія змішення розраховується по формулі:
ΔS
= qАr·RАr·ln·![]() + qN2·RN2·ln·
+ qN2·RN2·ln·![]() ,
,
ΔS
= 0,63·
·2,3·lq·![]() + 0,37·
·2,3·lq·
+ 0,37·
·2,3·lq·![]() = 0,0452 ккал/кг·град =
= 0,0452 ккал/кг·град =
= 0,189 кДж/кг·град
4 .Ентропія 1 кг суміші при заданих параметрах дорівнює:
S=SN2 + SAr + ΔS
S = 0.0398+0.0236+0.0452 = 0.1086ккал/кг * град = 0,456кДж./ кг * град
Приклад 2
Розрахувати зміну ентропії при переході 1 кг води, взятої при температур 25 °С, в стан перегрітої пари з t = 200 °С при нормальному тиску, при цьому:
а) теплоємність води становить 4,2 кДж/кг град, яка не залежить від
температури;
б) середня мольна теплоємність в межах температур 100-200"С дорівнює-
33.8 кДж/кмоль град;
в) теплота випарювання води - 2260 кДж/кг
Розв'язок
1 .Зміна ентропії (ДЛ')системи (1 варіант), визначається, як сума трьох величин
ΔS = ΔS1 + ΔS2 + ΔS3
де ΔS1 – зміна ентропії води при нагріванні її від 25 °С до 100 °С ;
ΔS2 – зміна ентропії при переході води із рідини в пару;
ΔS3 – зміна ентропії при перегріванні водяної пари до 200 °С ;
Розв’язок
Зміна ентропії (VS) системи І варіант, визначається, як сума трьох величин:
S = S1 + S2 + S3
де S1 – зміна ентропії води при нагріванні її від 25 °С до 100 °С ;
S2 – зміна ентропії при переході води із рідини в пару;
S3 – зміна ентропії при перегріванні водяної пари до 200 °С ;
а)
S1
=
![]() = Ср·2,3
lq·
= Ср·2,3
lq·![]() ;
;
S1
=
![]() = 4,2·2,3
lq·
= 4,2·2,3
lq·![]() = 0,94 кДж/кг;
= 0,94 кДж/кг;
б)
S2
=
![]()
S2
=
![]() = 6,06 кДж/кг;
= 6,06 кДж/кг;
в)
S3
=
![]() = Ср·2,3·lq·
= Ср·2,3·lq·![]() = 33.8.2,3·lq·1.268 = 8 кДж/кмоль =
= 33.8.2,3·lq·1.268 = 8 кДж/кмоль =
=
![]() = 0,44 кДж/кг ;
= 0,44 кДж/кг ;
S = 0,94 + 6,06 + 0,44 = 7,44 кДж/кг
Другий варіант
Величину зміни ентропії можливо підрахувати по таблицях [ ].
Для води в пароподібному стані
Для води в рідинному вигляді
Тоді
S0 = 189 – 70 = 119 кДж/кмоль
або
S0
=
![]() = 6,61 кДж/кг
= 6,61 кДж/кг
До цієї величини добавимо VS3 із попереднього розрахунку:
S0 = 6,61 + 0,44 = 7,05 кДж/кг
Приклад З
Розрахувати ентальпію суміші газів віднесену до 1НМ3 при температурі t=800°c"
Димові гази мають склад, %:
С02= 16.1; 0 = 7.5; N2 = 76.4
Розрахунок
1. Визначаємо ентальпію суміші газів, ентальпію компонентів знаходимо по таблицях [ ].
Ісум. = RСО2·ІСО2 + RО2·ІО2 + RN2·ІN2
ісум. = 0,161.207,4 + 0,075.194,1 + 0,764.207,9 = 208,2 ккал/кг = 872 кДж\кг
2. Розраховуємо ентальпію в кДж\НМ3
Ісум. = І·Р см
Рсум.
=
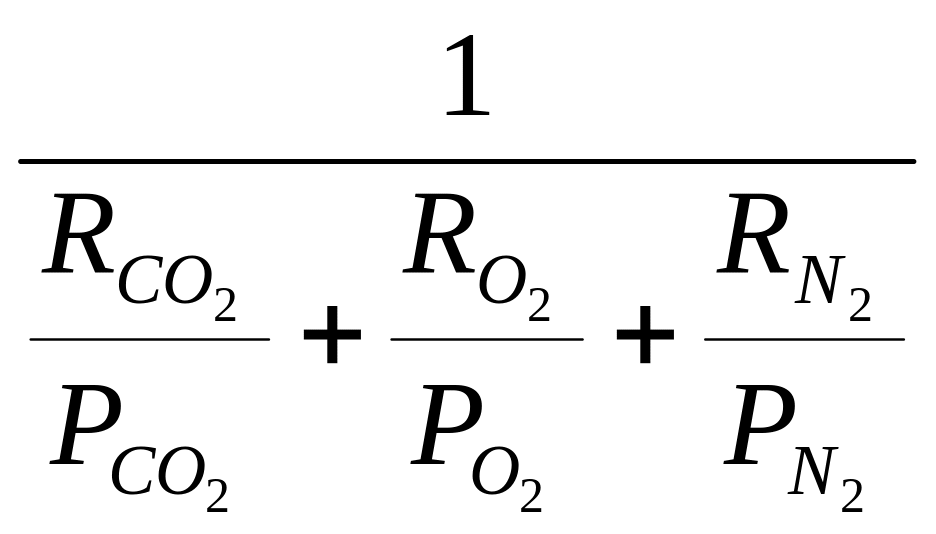
Рсум.
=
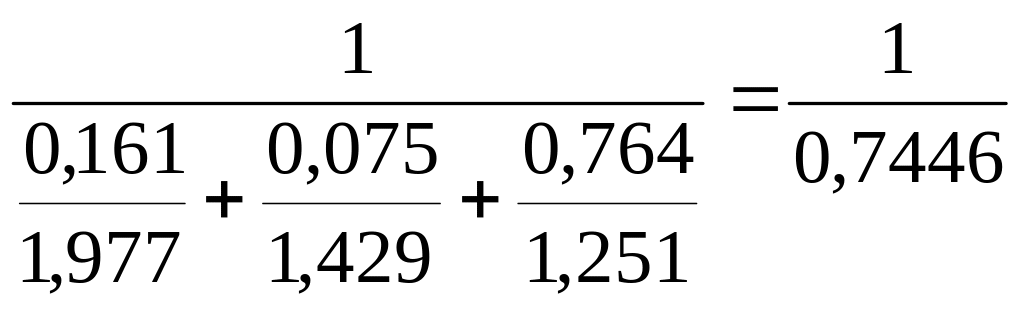 = 1,343 кг/нм³
= 1,343 кг/нм³
Тоді
Ісум. = 87,2·1,343 = 1171 кДж/нм³
