
Глава 12 оптическе свойства атомов, молекул и твердых тел
12.1. Оптические спектры атомов. Спектр атома водорода
Опыт
показывает, что спектры всех атомов,
т.е. распределения интенсивности
испускаемого и поглощаемого ими
электромагнитного излучения имеет
линейчатый (дискретный) характер. Это
означает, что зависимость интенсивности
от частоты испускаемого и поглощаемого
излучения I(w)
представляет собой набор острых пиков
(линий), соответствующих отдельным
(дискретным) значениям частоты
![]() разделенных
промежутками нулевой интенсивности
(рис. 5.1, а).
Этот набор частот, испускаемого атомом
излучения называют его оптическим
спектром. Спектр каждого элемента
качественно отличен от спектра любого
другого элемента. Поэтому измерение
длин волн спектральных линий, испускаемых
образцом, можно использовать для
идентификации присутствующих в образце
элементов. Измеряя относительные
интенсивности, испускаемых линий, и
проводя калибровочные опыты с известными
количествами исследуемых элементов,
можно определить и их количественный
состав. С другой стороны, изучение
спектров испускания и поглощения веществ
позволяет установить энергетические
уровни и тончайшие детали строения
атомов. Получение и анализ спектра
играет важную роль в теоретической и
прикладной оптике.
разделенных
промежутками нулевой интенсивности
(рис. 5.1, а).
Этот набор частот, испускаемого атомом
излучения называют его оптическим
спектром. Спектр каждого элемента
качественно отличен от спектра любого
другого элемента. Поэтому измерение
длин волн спектральных линий, испускаемых
образцом, можно использовать для
идентификации присутствующих в образце
элементов. Измеряя относительные
интенсивности, испускаемых линий, и
проводя калибровочные опыты с известными
количествами исследуемых элементов,
можно определить и их количественный
состав. С другой стороны, изучение
спектров испускания и поглощения веществ
позволяет установить энергетические
уровни и тончайшие детали строения
атомов. Получение и анализ спектра
играет важную роль в теоретической и
прикладной оптике.
Простейший спектр имеет атом водорода. Изучение его показало, что частоты всех линий, испущенных или поглощенных атомом водорода, подчиняется простой формуле
![]() (16.1)
(16.1)
где
![]() с
- 1
– так называемая постоянная Ридберга,
n
= 1, 2,
3,
… , m
= n
+ 1, n
+ 2, n
+ 3, … – целые
числа. Эта формула называется обобщенной
формулой Бальмера.
с
- 1
– так называемая постоянная Ридберга,
n
= 1, 2,
3,
… , m
= n
+ 1, n
+ 2, n
+ 3, … – целые
числа. Эта формула называется обобщенной
формулой Бальмера.
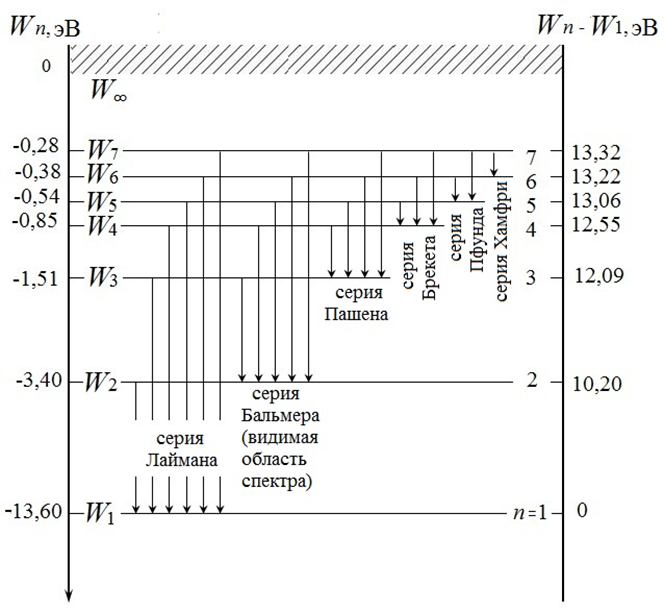
Рис. 12.
Линии
с одинаковыми значениями n
образуют группы линий, называемых
сериями. Число m
определяет положение (номер) линии в
серии. Серия, соответствующая n
= 1, называется
серией Лаймана, n
= 2 – серией
Бальмера, n
= 3 – серией
Пашена и т.д. Линии серии Лаймана
располагаются в ультрафиолетовой части
спектра. Четыре линии серии Бальмера,
обозначаемые как
![]() ,
располагаются в видимой области; а все
остальные линии этой серии и линии серий
с n
> 2 – в
ультрафиолетовой области. По мере
увеличения числа m
частоты линий каждой серии все больше
и больше сближаются друг с другом (линии
сгущаются), а их интенсивности уменьшаются
(рис. 16.1, а).
Значение
,
располагаются в видимой области; а все
остальные линии этой серии и линии серий
с n
> 2 – в
ультрафиолетовой области. По мере
увеличения числа m
частоты линий каждой серии все больше
и больше сближаются друг с другом (линии
сгущаются), а их интенсивности уменьшаются
(рис. 16.1, а).
Значение
![]() соответствует границе каждой серии
(наибольшей частоте), когда
соответствует границе каждой серии
(наибольшей частоте), когда
![]() .
Значение
.
Значение
![]() соответствует минимальной частоте –
головной линии серии. В серии Бальмера
такой головной линией является линия
соответствует минимальной частоте –
головной линии серии. В серии Бальмера
такой головной линией является линия
![]() ,
ей соответствует m
= n
+ 1 = 3. Линии
,
ей соответствует m
= n
+ 1 = 3. Линии
![]() соответствует
соответствует
![]() = 4, линии
= 4, линии
![]() –
m
= n
+ 3 = 5, линии
–
m
= n
+ 3 = 5, линии
![]() .
.
Формула
Бальмера представима также в виде
![]() т.е. каждую спектральную частоту можно
выразить разностью двух частот из
некоторого набора
т.е. каждую спектральную частоту можно
выразить разностью двух частот из
некоторого набора
![]() Частоты
Частоты
![]() называются спектральными термами.
Составляя различные комбинации термов,
можно найти все возможные частоты
спектральных линий атомов. Это справедливо
для спектров любых атомов и называется
комбинационным принципом Рица.
называются спектральными термами.
Составляя различные комбинации термов,
можно найти все возможные частоты
спектральных линий атомов. Это справедливо
для спектров любых атомов и называется
комбинационным принципом Рица.
В рамках классических представлений ни сам линейчатый характер спектра атома, ни тем более рассмотренные закономерности объяснить невозможно. Действительно, движущийся с ускорением (центростремительным) вокруг ядра электрон должен излучать электромагнитные волны с частотой, равной частоте его обращения вокруг ядра. Но при излучении электрон теряет энергию, вследствие чего радиус орбиты электрона будет непрерывно уменьшаться, а частота обращения его вокруг ядра непрерывно возрастать. Непрерывно будет увеличиваться и частота излучения электрона, и значит, спектр излучения атома должен быть непрерывным.
Линейчатый
характер спектра и происхождение
принципа Рица удалось объяснить Бору
еще до создания квантовой механики, но
в рамках квантовых представлений. Бор
понял, что линейчатый характер спектров
излучения и поглощения любого атома
свидетельствует о дискретности его
энергетического спектра. Основываясь
на квантовой гипотезе Планка, Бор
выдвинул два предположения (постулата).
1. Атом (электрон в атоме) может находиться
лишь в определенных, так называемых
стационарных состояниях, каждому из
которых соответствует одно из дискретных
значений энергии W
= W1,
W2,
W3,
… , Wm,
… , Wn,
. В стационарных состояниях, атом не
излучает и не поглощает электромагнитных
волн. 2. Излучение и поглощение света
происходит в виде квантов энергии
![]() при переходе атома из одного стационарного
состояния (m)
в другое (n).
Если атом переходит из состояния с
большей энергией в состояние с меньшей
энергией, то имеет место излучение волн,
причем каждый такой переход сопровождается
излучением отдельной спектральной
линии частоты
при переходе атома из одного стационарного
состояния (m)
в другое (n).
Если атом переходит из состояния с
большей энергией в состояние с меньшей
энергией, то имеет место излучение волн,
причем каждый такой переход сопровождается
излучением отдельной спектральной
линии частоты
![]() При переходе атома из состояния с меньшей
энергией в состояние с большей энергией
происходит поглощение волн. Пусть
При переходе атома из состояния с меньшей
энергией в состояние с большей энергией
происходит поглощение волн. Пусть
![]() –
изменение энергии электрона при переходе
из состояния с энергией Wm
в состояние с энергией Wn.
Тогда согласно второму постулату Бора
–
изменение энергии электрона при переходе
из состояния с энергией Wm
в состояние с энергией Wn.
Тогда согласно второму постулату Бора
![]()
![]() (16.2)
(16.2)
Это
соотношение, называемое правилом частот
Бора, выражает собой закон сохранения
энергии при излучении и поглощении:
уменьшение (при
![]() )
или увеличение (при
)
или увеличение (при
![]() )
энергии атома при переходе из одного
состояния в другое равно энергии
)
энергии атома при переходе из одного
состояния в другое равно энергии
![]() ,
уносимой или приносимой квантом излучения
– фотоном. Из сопоставления соотношения
(16.2) с формулой Бальмера получается
выражение для энергии атома водорода
в некотором стационарном состоянии:
,
уносимой или приносимой квантом излучения
– фотоном. Из сопоставления соотношения
(16.2) с формулой Бальмера получается
выражение для энергии атома водорода
в некотором стационарном состоянии:
![]() Тем самым с каждым спектральным термом
Тем самым с каждым спектральным термом
![]() Бор связал энергию Wn
и предположил, что энергетический
спектр атома исчерпывается этими
значениями энергии. Выдвинув третий
постулат, согласно которому момент
импульса электрона в стационарном
состоянии является целым кратным
постоянной Планка
Бор связал энергию Wn
и предположил, что энергетический
спектр атома исчерпывается этими
значениями энергии. Выдвинув третий
постулат, согласно которому момент
импульса электрона в стационарном
состоянии является целым кратным
постоянной Планка
![]() |l|
=
|l|
=
![]() ,
Бор получил формулу энергии электрона
в атоме водорода
,
Бор получил формулу энергии электрона
в атоме водорода
![]() где
где
![]() = 13,6 эВ – есть энергия ионизации атома
водорода, m
– масса электрона, e
– заряд электрона. Сравнивая обе
полученные формулы для Wn,
Бор получил числовое значение постоянной
Ридберга, которое с большой точностью
совпало с экспериментальным значением.
= 13,6 эВ – есть энергия ионизации атома
водорода, m
– масса электрона, e
– заряд электрона. Сравнивая обе
полученные формулы для Wn,
Бор получил числовое значение постоянной
Ридберга, которое с большой точностью
совпало с экспериментальным значением.
Квантовая
механика подтвердила формулу Бора для
энергии электрона в атоме водорода,
но исправила формулу для орбитального
момента импульса, заменив ее формулой
|l|
= =
![]() где l
= 0, 1,
2,
…, n
– 1 – орбитальное
квантовое число. Следует отметить также,
что все атомные состоянии, строго говоря,
вполне стационарными не являются,
поскольку атомы из этих состояний
самопроизвольно переходят в состояния
с наименьшей энергией. Только атом,
находящийся на самом нижнем энергетическом
уровне (в основном состоянии), не может
излучать: он устойчив.
где l
= 0, 1,
2,
…, n
– 1 – орбитальное
квантовое число. Следует отметить также,
что все атомные состоянии, строго говоря,
вполне стационарными не являются,
поскольку атомы из этих состояний
самопроизвольно переходят в состояния
с наименьшей энергией. Только атом,
находящийся на самом нижнем энергетическом
уровне (в основном состоянии), не может
излучать: он устойчив.
Из сравнения выражений для энергии Wn следует, что целые числа m и n – это значения главного квантового числа, определяющего квантованные (дискретные) значения энергии электрона в атоме водорода (энергетические уровни атома водорода). В формуле Бальмера они определяют номера уровней, между которыми осуществляется переход электрона при излучении (если m > n) или при поглощении (если m < n) электромагнитного излучения. Следовательно, серия Лаймана в спектре излучения атома водорода возникает при переходе электрона со всех вышестоящих уровней на первый (основной, n = 1) уровень, серия Бальмера – на второй (n = 2), серия Пашена – на третий (n = 3) и т.д. В спектре поглощения серия Лаймана возникает при переходе электрона с основного уровня на различные возбужденные уровни. Именно потому, что серия Лаймана соответствует переходу электрона с основного уровня, только эта серия и наблюдается в спектре поглощения атома водорода. Графически процесс излучения и поглощения можно изобразить стрелкой, соединяющей те два энергетических уровня Wm и Wn (состояния с энергиями Wm и Wn), при переходе между которыми происходит испускание или поглощение кванта света . Все серии излучения и соответствующие им переходы в атоме водорода показаны на рис. 16.1, б.
Возникновение линейчатых спектров и постулаты Бора получили свое обоснование в квантовой теории.
