
- •Методичні вказівки
- •Хід роботи і аналітична група катіонів
- •Іі аналітична група катіонів
- •Амоній карбонат (nh4)2со3 утворює з розчинами солей Кальцію білий аморфний осад СаСо3, який під час нагрівання переходить у кристалічний:
- •Ііі аналітична група катіонів
- •IV аналітична група катіонів
- •Аналітичні реакції на аніони і групи
- •1. Аніони sо42- - реакція з барій хлоридом
- •2. Аніон со32- - реакція з кислотами
- •3. Аніон ро43- - реакція з аргентум нітратом
- •Аналітичні реакції на аніони іі групи
- •1. Аніон сі- - реакція з аргентум нітратом Аргентум нітрат AgNо3 за наявності нітратної кислоти осаджує з розчинів хлоридів білий осад AgСі:
- •2. Аніон s2- - реакція з аргентум нітратом
- •Аналітичні реакції на аніони ііі групи
- •1. Аніон nо3- - реакція з ферум (іі) сульфатом
- •2. Аніон сн3соо- - реакція з ферум (ііі) хлоридом
- •Тема: Вивчення основних операцій гравіметричного аналізу
- •Методичні вказівки
- •Хід роботи
- •1. Розрахунок наважки речовини, яка аналізується
- •2. Взяття наважки
- •3. Перенесення наважки.
- •4. Розчинення наважки
- •5. Осадження
- •6. Фільтрування і промивання осаду.
- •7. Висушування і прожарювання осаду.
- •Після виконання лабораторного заняття студенти повинні:
- •Контрольні запитання
- •Тема: Визначення вологості сировини чи готової продукції харчових виробництв методом висушування до сталої маси
- •Методичні вказівки
- •Хід роботи
- •Розрахунок
- •Тема: Визначення зольності сировини чи готової продукції харчових виробництв
- •Методичні вказівки
- •Хід роботи
- •Розрахунок
- •Визначення вмісту золи
- •1. Ознайомлення з мірним посудом і його призначенням Методичні вказівки
- •Методичні вказівки
- •Хід роботи
- •Приготування розчину лугу з приблизною концентрацією
- •Приготування стандартного розчину щавлевої кислоти
- •Визначення точної концентрації розчину лугу за розчином щавлевої кислоти
- •Тема: Визначення загальної твердості води трилонометричним методом
- •Хід роботи
- •Методичні вказівки
- •Хід роботи
- •Методичні вказівки
- •Хід роботи
- •Приготування стандартного розчину купрум (іі)сульфату
- •3. Побудова калібрувального графіка
- •Методичні вказівки
- •Хід роботи
- •1. Визначення рН розчину методом прямої потенціометрії
- •2. Визначення вмісту сильної кислоти в розчині методом потенціометричного титрування
- •Методичні вказівки
- •Хід роботи
- •Методичні вказівки
- •Хід роботи
- •Розділення суміші катіонів методом іонообмінної хроматографії
- •Методика розділення
- •2. Якісний аналіз суміші амінокислот методом паперової хроматографії
- •Після виконання лабораторного заняття студенти повинні:
- •Контрольні запитання
МІНІСТЕРСТВО АГРАРНОЇ ПОЛІТИКИ ТА ПРОДОВОЛЬСТВА УКРАЇНИ
ТЕХНОЛОГО-ЕКОНОМІЧНИЙ КОЛЕДЖ
БІЛОЦЕРКІВСЬКОГО НАЦІОНАЛЬНОГО АГРАРНОГО УНІВЕРСИТЕТУ
ІНСТРУКЦІЙНА КАРТКА
Для проведення лабораторної роботи № 1,2
з навчальної дисципліни
«Аналітичної хімія»
Тема: Аналітичні реакції катіонів.
Аналітичні реакції аніонів
Мета: Ознайомитися з основними аналітичними реакціями на катіони і аніони та умовами їх проходження
Реактиви і обладнання: Розчини калій хлориду, натрій хлориду, амоній хлориду, кальцій хлориду, барій хлориду, алюміній хлориду, ферум (ІІ) заліза, ферум (ІІІ) хлориду, купрум (ІІ) сульфату, плюмбум (ІІ) ацетату, аргентум нітрату, натрій гексанітрокобальтату, калій гексагідроксистибіату (v), амоній карбонату, натрій сульфату, калій гексаціаноферату (ІІІ), калій гексаціаноферату (ІІ), калій хромату, натрій
гідроксид, сульфатної кислоти, хлоридної кислоти, нітратної кислоти (0,1 н), оцтової кислоти, натрій карбонату, натрій гідрофосфату, натрій сульфіду, натрій нітрату, натрій ацетату, ферум (ІІ) сульфату, скляні палички, пробірки, індикаторний папір, спиртівка, сірники.
Методичні вказівки
В якісному аналізі катіони виявляються окремо від аніонів. Тому розрізняють аналіз катіонів і аніонів.
Багато катіонів схожі між собою за властивостями і їх при систематичному аналізі поділяють на групи, які в свою чергу поділяються на підгрупи.
Аналітичною групою катіонів у хімічному аналізі називається така група, катіони якої при взаємодії з певним реактивом і за певних умов вступають в характерні реакції. За допомогою цих реакцій можна відокремити певну групу катіонів від іншої. Кожна аналітична група має свій характерний реактив –осаджувач, за допомогою якою осаджують всі катіони цієї групи.
До І аналітичної групи відносять: Na+, K+, NH4+, Mg2+.
До ІІ аналітичної групи відносять: Ва2+, Sr2+, Са2+.
До ІІІ аналітичної групи відносять: Аl3+, Сr3+, Fe3+,Fe2+,Mn2+,Zn2+,Ni2+,Co2+.
До ІV аналітичної групи відносять: Ag+, Hg+, Pb2+, Cu2+, Hg2+, Cd2+.
Аніони в меншій мірі заважають виявленню один одного, тому під час їх аналізу частіше використовують роздрібнений метод. На відміну від аналізу катіонів, де групи послідовно відділяють одна від одної груповим реактивом, в аналізі аніонів груповий реактив частіше використовують тільки для попереднього виявлення групи.
До І аналітичної групи відносять: SO42-, SO32 -, S2O32 -,CO32 -, PO43 -, SiO32 -,
BO2-, B4O72 -.
До ІІ аналітичної групи відносять: С1 -, Br -, I -, S2 -.
До ІІІ аналітичної групи відносять: NO3-, NO2-, СН3СОО-.
Хід роботи і аналітична група катіонів
1. Катіон К+ - реакція з натрій гідрогентартратом
Натрій гідрогентартрат NaHC4H4O6 утворює з йонами Калію білий кристалічний осад калій гідрогентартрату:
К+ + HC4H4O6- = КHC4H4O6 ↓
В и к о н а н н я. У пробірку вносять 4-5 крапель розчину солі Калію і стільки ж розчину реактиву. Розчин охолоджують і потирають об внутрішні стінки пробірки скляною паличкою для прискорення утворення осаду. Середовище має бути нейтральним або слабкокислотним. Чутливість реакції – 50 мкг, граничне розбавляння – 1:1000. Катіони NH4+ перешкоджають визначенню, тому їх усувають шляхом прожарювання проби.
2. Катіони Na+ - реакція з калій гексагідроксостибіатом (V)
Калій дигідрогенстибіат КН2SbO4 у нейтральному середовищі утворює з йонами Натрію білий кристалічний осад натрій дигідрогенстибіату
Na + Н2SbО4- = NaН2SbО4 ↓,
а з гексагідроксостибіатом (V) – такий самий осад натрій гексагідроксостибіату (V) за рівнянням:
Na+ + [Sb(OH)6]- = Na[Sb(OH)6] ↓
В и к о н а н н я. У пробірку вносять 4-5 крапель розчину солі Натрію і такий самий об’єм реактиву. Реакцію виконують при охолодженні й потиранні стінок пробірки скляною паличкою. Досліджуваний розчин не повинен містити вільних кислот, оскільки вони взаємодіють з цим реактивом, а також солей амонію.
3. Катіон NH4+
Реакція з гідроксидами лужних металів. Сильні основи NaОН, КОН виділяють із розчинів солей амонію газуватий амоніак, який можна виявити за характерним запахом або за допомогою кислотно-основних індикаторів:
NH4+ + ОН- → NH3↑ + Н2О
Реакція з лугами дуже чутлива (0,01 мкг) і дає змогу виявити йони амонію за наявності всіх інших катіонів.
В и к о н а н н я. У пробірку вносять кілька крапель розчину солі амонію і добавляють 3-4 краплі 2М розчину лугу. До отвору пробірки підносять змочений водою червоний лакмусовий папірець і нагрівають пробірку. Спостерігають посиніння лакмусового папірця, оскільки амоніак, що виділяється, сполучаючись з водою, утворює амоній гідроксид:
NH3 + Н2О → NH4ОН,
який забарвлює лакмусовий папірець у синій колір.
Дія реактиву Несслера. Реактив Несслера – це суміш комплексної солі Меркурію К2[HgI4] з КОН. Вона утворює з солями амонію бурий осад:
NH4+ + 2[HgI4]2- + 2ОН- → [І2Hg2NH2]І(т) + 5І- + 2Н2О
У молекулярному вигляді це рівняння записують так:
NH4СІ + 2К2[HgI4] + 2КОН = [І2Hg2NH2]І(т) + 5КІ + КСІ + Н2О
Структуру утвореної комплексної сполуки можна зобразити так:
І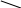

 – Hg
– Hg
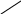 NH2
I
NH2
I
I – Hg
Реакція характеризується високою чутливістю (0,25 мкг), тому її використовують для перевірки повноти виділення амоніаку з реакційної суміші.
В и к о н а н н я. До 1-2 крапель розчину амонійної солі добавляють 4-5 крапель реактиву Несслера і спостерігають утворення бурого осаду. За незначного вмісту солей амонію в пробі з’являється жовте забарвлення.
