
- •Введение
- •Лабораторная работа № 1. Выбор состава и приготовление буферного раствора с заданным значением рН
- •Приборы и реактивы.
- •Выполнение работы
- •I. Выбрать реактивы для приготовления буферного раствора.
- •II. Рассчитать объемы реактивов для приготовления буферного раствора.
- •III. Приготовить буферный раствор и определить его рН
- •IV. Определить буферную емкость
- •Протокол лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 2. Определение концентрации ионов меди методом прямой потенциометрии
- •Оборудование и реактивы
- •Выполнение работы
- •I. Приготовить серию контрольных растворов с содержанием определяемого иона 101, 102, 103, 104 моль/кг методом последовательного разведения.
- •II. Получить градуировочную зависимость и измерить эдс пробы при помощи ионоселективного электрода.
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 3. Определение концентрации ионов I– и Cl– методом потенциометрического титрования
- •Оборудование и реактивы
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 4. Определение содержания кислоты методом потенциометрического титрования
- •Оборудование и реактивы:
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 6. Определение концентрации кислоты методом кондуктометрического титрования.
- •Оборудование и реактивы
- •Выполнение работы
- •Протокол лабораторной работы
- •Обработка экспериментальных данных
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 7. Анализ смеси кислот и солей слабых оснований методом кондуктометрического титрования.
- •Оборудование и реактивы
- •Выполнение работы
- •Протокол лабораторной работы
- •Обработка экспериментальных данных
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 8. Разделение меди и цинка на катионите
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 9. Экстракция цветных металлов карбоновыми кислотами
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 10. Определение концентрации железа (III) фотометрическим методом с роданидом калия
- •Оборудование и реактивы
- •Выполнение работы
- •I. Приготовление рабочего раствора соли железа.
- •II. Получение градуировочной зависимости
- •III. Проведение анализа пробы
- •Протокол лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 11. Определение концентрации никеля фотометрическим методом с диметилглиоксимом
- •I. Приготовление рабочего раствора соли никеля
- •II. Получение градуировочной зависимости
- •III. Проведение анализа пробы
- •Протокол лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 12. Определение сульфат-иона турбидиметрическим методом
- •Оборудование и реактивы.
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 13. Фотометрическое определение цветности воды
- •Оборудование и реактивы
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная Работа № 14. Получение спектра поглощения и определение аналитической длины волны
- •Оборудование и реактивы.
- •Выполнение работы
- •1. Приготовить рабочий раствор соли железа:
- •2. Приготовить раствор роданидного комплекса железа для получения спектра:
- •3. Приготовить раствор сравнения для получения спектра:
- •4. Получение спектра поглощения роданидного комплекса железа
- •5. Получение спектра поглощения раствора сульфата никеля
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Содержание
Содержание протокола лабораторной работы
1. Концентрация стандартного раствора хлорида натрия Cст.р-р(NaCl) = …….г/л
2. Результаты измерения электропроводности контрольных и исследуемого растворов
№ |
Vст. р-ра(NaCl) |
Удельная электропроводность, |
Единицы измерения |
1 |
1 |
|
|
2 |
2 |
|
|
… |
… |
|
|
7 |
задача |
|
|
Обработка результатов эксперимента
1. Заполнить таблицу
№ |
Vст. р-ра(NaCl) |
С(NaCl), г/л |
, См/м |
1 |
1 |
|
|
2 |
2 |
|
|
3 |
4 |
|
|
4 |
6 |
|
|
5 |
8 |
|
|
6 |
10 |
|
|
2. Построить градуировочную зависимость в координатах – С(Cl–).
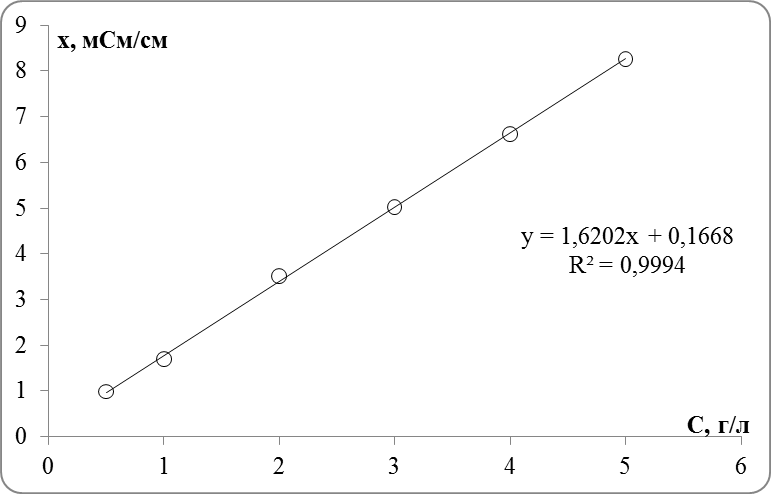
3. Вывести уравнение линии тренда (линейная)
4. По уравнению линии тренда определить содержание хлорида натрия в пробе в г/л.
Содержание отчета по лабораторной работе
1. Название работы
2. Цель работы
3. Ход эксперимента
4. Экспериментальные данные согласно протоколу лабораторной работы
5. Обработка экспериментальных данных
6. Выводы.
Лабораторная работа № 6. Определение концентрации кислоты методом кондуктометрического титрования.
Цель работы. Определить содержание кислоты в заданном растворе методом кондуктометрического титрования.
Сущность работы. При титровании сильной кислоты щелочью электропроводность раствора до точки эквивалентности линейно понижается, т.к. нейтрализуются высокоподвижные ионы водорода. Нейтрализация слабой кислоты сопровождается повышением проводимости раствора до точки эквивалентности, что объясняется образованием хорошо диссоциирующей соли. Избыток щелочи при титровании вызывает резкое повышение электропроводности раствора.
Оборудование и реактивы
Кондуктометр; Магнитная мешалка; Бюретка; электрод; Пипетка Мора на 10 мл; Сосуд для титрования (химический стакан на 200 мл); Гидроксид натрия; Проба – задача № 1 – 3.
Выполнение работы
1. При помощи мерной пипетки отобрать пробу для титрования в химический стакан объемом 150 – 200 мл.
2. В бюретку залить раствор щелочи и «занулить».
3. Стакан с пробой поставить на магнитную мешалку.
4. Поместить в стакан якорь для перемешивания.
5. Опустить в стакан с пробой электрод для измерения электропроводности. Электрод следует опустить максимально низко, однако он не должен мешать перемешиванию раствора. Щель электрода должна быть закрыта раствором. Для этого следует добавить дистиллированную воду.
6. Собрать установку для проведения титрования
7. Включить кондуктометр.
8. Запустить магнитную мешалку.
9. Записать значение электропроводности на экране прибора, не забыв отметить единицы измерения.
10. Титровать пробу кислоты с шагом 0,5 мл, фиксируя значение электропроводности после добавления каждой порции титранта.
11. Титрант добавлять до получения перегиба зависимости χ = f(VT).
12. После перегиба следует получить еще 5-7 точек.
13. Результаты измерений заносят в таблицу.
