
- •Введение
- •Лабораторная работа № 1. Выбор состава и приготовление буферного раствора с заданным значением рН
- •Приборы и реактивы.
- •Выполнение работы
- •I. Выбрать реактивы для приготовления буферного раствора.
- •II. Рассчитать объемы реактивов для приготовления буферного раствора.
- •III. Приготовить буферный раствор и определить его рН
- •IV. Определить буферную емкость
- •Протокол лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 2. Определение концентрации ионов меди методом прямой потенциометрии
- •Оборудование и реактивы
- •Выполнение работы
- •I. Приготовить серию контрольных растворов с содержанием определяемого иона 101, 102, 103, 104 моль/кг методом последовательного разведения.
- •II. Получить градуировочную зависимость и измерить эдс пробы при помощи ионоселективного электрода.
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 3. Определение концентрации ионов I– и Cl– методом потенциометрического титрования
- •Оборудование и реактивы
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 4. Определение содержания кислоты методом потенциометрического титрования
- •Оборудование и реактивы:
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 6. Определение концентрации кислоты методом кондуктометрического титрования.
- •Оборудование и реактивы
- •Выполнение работы
- •Протокол лабораторной работы
- •Обработка экспериментальных данных
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 7. Анализ смеси кислот и солей слабых оснований методом кондуктометрического титрования.
- •Оборудование и реактивы
- •Выполнение работы
- •Протокол лабораторной работы
- •Обработка экспериментальных данных
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 8. Разделение меди и цинка на катионите
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 9. Экстракция цветных металлов карбоновыми кислотами
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 10. Определение концентрации железа (III) фотометрическим методом с роданидом калия
- •Оборудование и реактивы
- •Выполнение работы
- •I. Приготовление рабочего раствора соли железа.
- •II. Получение градуировочной зависимости
- •III. Проведение анализа пробы
- •Протокол лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 11. Определение концентрации никеля фотометрическим методом с диметилглиоксимом
- •I. Приготовление рабочего раствора соли никеля
- •II. Получение градуировочной зависимости
- •III. Проведение анализа пробы
- •Протокол лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 12. Определение сульфат-иона турбидиметрическим методом
- •Оборудование и реактивы.
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 13. Фотометрическое определение цветности воды
- •Оборудование и реактивы
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная Работа № 14. Получение спектра поглощения и определение аналитической длины волны
- •Оборудование и реактивы.
- •Выполнение работы
- •1. Приготовить рабочий раствор соли железа:
- •2. Приготовить раствор роданидного комплекса железа для получения спектра:
- •3. Приготовить раствор сравнения для получения спектра:
- •4. Получение спектра поглощения роданидного комплекса железа
- •5. Получение спектра поглощения раствора сульфата никеля
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Содержание
Обработка результатов эксперимента
1. Данные эксперимента заносят в таблицу:
Объем титранта VT, мл |
Е, мВ |
|
0 |
Е0 |
|
0,5 |
Е1 |
1 |
1,0 |
Е2 |
2 |
… |
… |
|
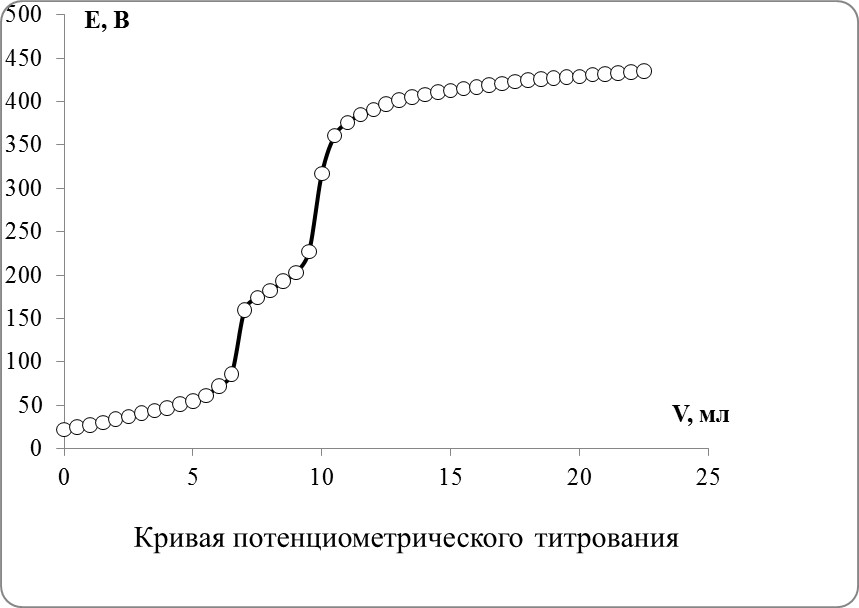
2. По данным таблицы построить кривую потенциометрического титрования в координатах E – VТ. На кривой титрования должно быть два перегиба, первый из которых соответствует титрованию иодид- а второй – хлорид-иона
3. Вычислить значения , где ΔV – шаг титрования (0,5 мл); ΔЕ =Еn+1−En,
например, ΔЕ1=Е1−Е0, ΔЕ2=Е2−Е1 и т. д.
4. Построить дифференциальную кривую титрования в координатах −VТ.
5. На дифференциальной кривой обозначится два острых максимума, первый из которых соответствует титрованию иодид-иона VI а второй – хлорид-иона VCl.
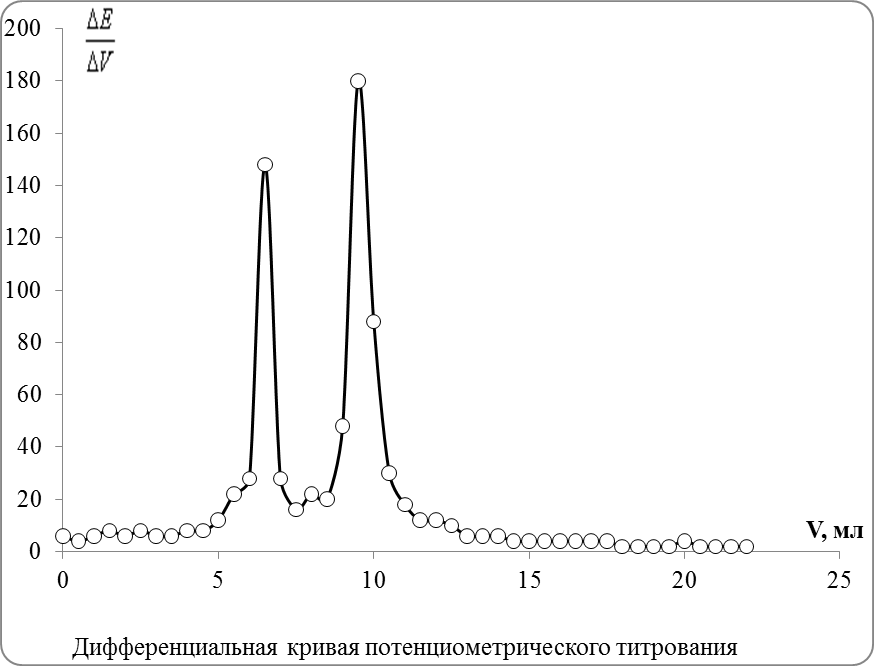
5. По положению острых максимумов дифферециальной кривой титрования находят точки эквивалентности.
6. Рассчитать концентрацию ионов I– и Сl–в растворе по формулам:
 ,
, ,
,
где VI и VCl– объем AgNO3в точках эквивалентности; СТ – концентрация ратсвора AgNO3; Va – объем пробы, взятой для анализа, мл.
Содержание отчета по лабораторной работе
1. Название работы
2. Цель работы
3. Ход эксперимента
4. Экспериментальные данные согласно протоколу лабораторной работы
5. Обработка экспериментальных данных
6. Выводы.
Лабораторная работа № 4. Определение содержания кислоты методом потенциометрического титрования
Цель работы: определить концентрацию кислоты в предложенной пробе.
Сущность работы: Определение уровня кислотности основано на реакции нейтрализации: Н++ОН−→Н2О. Вследствие протекания реакции потенциал стеклянного электрода постепенно понижается. Как только все ионы Н+ окажутся связанными, наступает резкий скачок потенциала. При дальнейшем добавлении щелочи потенциал электрода меняется незначительно. Электродом сравнения служит хлорсеребряный электрод. В данной работе надо получить зависимость ЭДС от объема добавленной щелочи – кривую титрования. Определить точку эквивалентности и вычислить концентрацию кислоты в пробе.
Оборудование и реактивы:
рН-метр; стеклянный электрод; хлорсеребряный электрод; комбинированный электрод; магнитная мешалка; якорь магнитной мешалки; стакан для титрования объемом 150-200 мл; стакан для щелочи объемом 50 мл; мерная пипетка (пипетка Мора) объемом 10 мл; бюретка для титрования объемом 25 мл; гидроксид натрия, 0,1 н.; проба для анализа (растворы азотной, серной или фосфорной кислоты).
Выполнение работы
В стакан для титрования мерной пипеткой отбирают пробу кислоты 10 мл.
Стакан с пробой устанавливают на магнитной мешалке.
Подключают электроды к рН-метру: стеклянный электрод – к гнезду «ИЗМ.», хлорсеребряный – к гнезду «ВСПОМ.» ИЛИ комбинированный электрод – к гнезду «ИЗМ.».
Электроды погружают в стакан с пробой.
Доливают дистиллированную воду так, чтобы электроды были прогружены в раствор как минимум на 2 см.
Включают рН-метр в режим измерения ЭДС и записывают показания прибора в таблицу.
Титруют раствором NaOH с шагом 0,5 мл После добавления каждой порции NaOH фиксируют значение ЭДС. Титрование продолжают до получения постоянного значения э.д.с. после прибавления новой порции титранта.
Результаты эксперимента заносят в таблицу.

