
- •Введение
- •Лабораторная работа № 1. Выбор состава и приготовление буферного раствора с заданным значением рН
- •Приборы и реактивы.
- •Выполнение работы
- •I. Выбрать реактивы для приготовления буферного раствора.
- •II. Рассчитать объемы реактивов для приготовления буферного раствора.
- •III. Приготовить буферный раствор и определить его рН
- •IV. Определить буферную емкость
- •Протокол лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 2. Определение концентрации ионов меди методом прямой потенциометрии
- •Оборудование и реактивы
- •Выполнение работы
- •I. Приготовить серию контрольных растворов с содержанием определяемого иона 101, 102, 103, 104 моль/кг методом последовательного разведения.
- •II. Получить градуировочную зависимость и измерить эдс пробы при помощи ионоселективного электрода.
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 3. Определение концентрации ионов I– и Cl– методом потенциометрического титрования
- •Оборудование и реактивы
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 4. Определение содержания кислоты методом потенциометрического титрования
- •Оборудование и реактивы:
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 6. Определение концентрации кислоты методом кондуктометрического титрования.
- •Оборудование и реактивы
- •Выполнение работы
- •Протокол лабораторной работы
- •Обработка экспериментальных данных
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 7. Анализ смеси кислот и солей слабых оснований методом кондуктометрического титрования.
- •Оборудование и реактивы
- •Выполнение работы
- •Протокол лабораторной работы
- •Обработка экспериментальных данных
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 8. Разделение меди и цинка на катионите
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 9. Экстракция цветных металлов карбоновыми кислотами
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 10. Определение концентрации железа (III) фотометрическим методом с роданидом калия
- •Оборудование и реактивы
- •Выполнение работы
- •I. Приготовление рабочего раствора соли железа.
- •II. Получение градуировочной зависимости
- •III. Проведение анализа пробы
- •Протокол лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 11. Определение концентрации никеля фотометрическим методом с диметилглиоксимом
- •I. Приготовление рабочего раствора соли никеля
- •II. Получение градуировочной зависимости
- •III. Проведение анализа пробы
- •Протокол лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 12. Определение сульфат-иона турбидиметрическим методом
- •Оборудование и реактивы.
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 13. Фотометрическое определение цветности воды
- •Оборудование и реактивы
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная Работа № 14. Получение спектра поглощения и определение аналитической длины волны
- •Оборудование и реактивы.
- •Выполнение работы
- •1. Приготовить рабочий раствор соли железа:
- •2. Приготовить раствор роданидного комплекса железа для получения спектра:
- •3. Приготовить раствор сравнения для получения спектра:
- •4. Получение спектра поглощения роданидного комплекса железа
- •5. Получение спектра поглощения раствора сульфата никеля
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Содержание
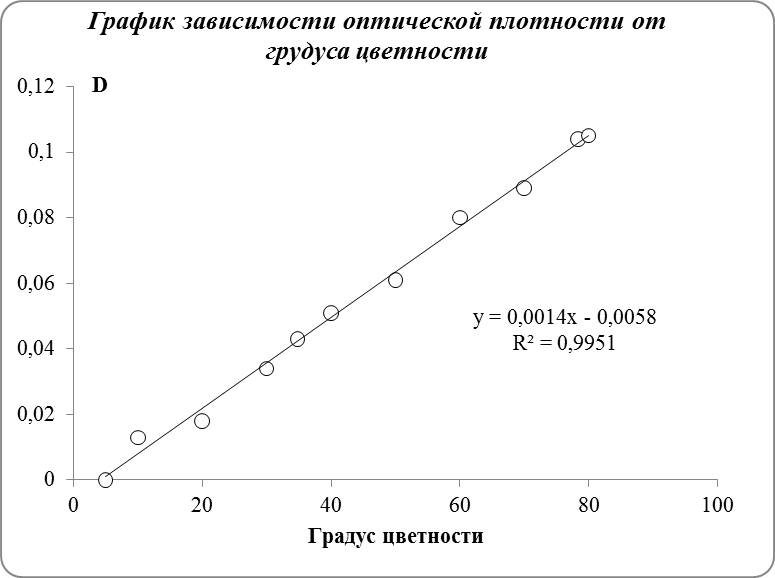
Обработка результатов эксперимента
1. Построить градуировочную зависимость в координатах оптическая плотность – градус цветности
2. По градуировочному графику определить цветность пробы воды.
Содержание отчета по лабораторной работе
1. Название работы
2. Цель работы
3. Ход эксперимента
4. Экспериментальные данные согласно протоколу лабораторной работы
5. Обработка экспериментальных данных
6. Выводы.
Лабораторная Работа № 14. Получение спектра поглощения и определение аналитической длины волны
Цель работы. Построение кривых светопоглощения, выбор оптимального участка длин волн и определение в растворе концентрации соли железа в присутствии соли никеля.
Сущность работы. Растворы солей никеля и тиоцианатного комплекса железа имеют различную окраску, что позволяет выделить участок спектра, где светопоглощение комплексом железа велико, а светопоглощение раствором соли никеля незначительно. При этой длине волны оптическая плотность раствора будет почти целиком определяться концентрацией железа.
Оборудование и реактивы.
Спектрофотометр или фотоколориметр;
кюветы толщиной 1 см – 2 шт;
колба мерная емкостью 200 мл – 1 шт.;
колба мерная емкостью 100 мл – 2 шт.; колба мерная емкостью 50 мл – 8 шт.;
стакан химический объемом 100 мл – 6 шт.;
пипетка градуированная объемом 10 мл – 4 шт.;
пипетка мерная объемом 5 мл – 1 шт.;
стандартный раствор соли железа [(NH4)Fe(SO4)212H2O], содержащий 2 г/л железа (III);
стандартный раствор соли никеля, содержащий 10 г/л никеля;
тиоцианат (роданид) калия или аммония – 1 М раствор;
соляная кислота – 2 н. раствор
Выполнение работы
1. Приготовить рабочий раствор соли железа:
1) в маркированный химический стакан налить порцию стандартного раствора соли железа;
2) градуированной пипеткой отобрать из стакана 5 мл стандартного раствора соли железа и перенести в мерную колбу объемом 200 мл;
3) довести объем раствора до метки дистиллированной водой;
4) закрыть колбу пробкой и перемешать, переворачивая колбу не менее 20 раз.
Рабочий раствор соли железа сохранить до конца выполнения лабораторной работы.
2. Приготовить раствор роданидного комплекса железа для получения спектра:
1) в мерную колбу на 100 мл № 1 при помощи градуированных пипеток отобрать
10 мл рабочего раствора соли железа,
8 мл 2 н. раствора HCl,
8 мл 10 % раствора роданида калия;
2) довести объем раствора до метки дистиллированной водой и перемешать.
В мерной колбе № 1 получится окрашенный раствор роданидного комплекса железа (III).
3. Приготовить раствор сравнения для получения спектра:
1) в мерную колбу на 100 мл № 2 отобрать
10 мл 2 н. раствора HCl,
10 мл раствора роданида калия
2) довести объем растора до метки дистиллированной водой и перемешать.
В мерной колбе № 2 получится практически бесцветный раствор сравнения, относительно которого фотометрируют окрашенный раствор роданидного комплекса железа (мерная колба на 100 мл № 1).
4. Получение спектра поглощения роданидного комплекса железа
1) В кювету толщиной 1 см налить до метки раствор сравнения и насухо протереть стенки кюветы салфеткой.
2) Кювету с раствором сравнения поместить в дальнее отделение кюветодержателя.
3) В другую кювету толщиной 1 см налить до метки окрашенный раствор, содержащий роданидный комплекс железа (III) и насухо протереть стенки салфеткой.
4) Кювету с окрашенным раствором поместить в ближнее отделение кюветодержателя.
5) Кюветодержатель поместить в кюветное отделение прибора.
6) Измерить оптическую плотность раствора при различных длинах волн в диапазоне от 400 до 600 нм с шагом 20 нм, следуя инструкции к пользованию прибором. Результаты измерений занести в таблицу 1.
