
- •8 Класс
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •9 Класс
- •Решение
- •Уравнения реакций (по 0,5 балла) - 5 баллов Итого 10 баллов
- •Решение
- •Итого – 10 баллов
- •Решение
- •Решение
- •Итого – 10 баллов
- •Итого – 10 баллов
- •Решение
- •Решение
- •Уравнение горения аммиака – 2 балла
- •Нахождение доли аммиака с пояснением и расчетом – 6 баллов
- •Итого – 10 баллов
- •10 Класс
- •Решение
- •Решение
- •Решение
- •Решение
- •11 Класс
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение:
8 Класс
№1
В какой массе воды необходимо растворить 213 г оксида фосфора (V) для получения раствора с массовой долей растворенного вещества в нем 49%? Запишите молекулярную и структурную формулы этого вещества, назовите его.
Решение
При растворении Р2О5 в воде происходит реакция с образованием фосфорной кислоты:
213 г
Р2О5 + 3Н2О = 2H3PO4
142 г/моль 98 г/моль
Из 213 г Р2О5 получается: m(H3PO4) = 213·2·98:142 = 294 (г)
Масса раствора фосфорной кислоты: m(раствора H3PO4) = 294:0,49 = 600 (г).
Суммарная масса исходных веществ тоже равна 600 г. Следовательно, масса взятой воды равна: m(H2O) = 600 – 213 = 387 (г)
Структурная формула фосфорной кислоты:
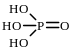
№2
Атомная масса элемента Х относится к молекулярной массе его бромида как 1 : 5. Определите формулу этого соединения. Назовите его. Ответ подтвердите расчетами.
Решение
Запишем формулу неизвестного бромида в виде ЭBrn.
Пусть атомная масса неизвестного элемента равна х, тогда молекулярная масса бромида равна х+80n.
Тогда (х+80n):х = 5. Отсюда х = 20n.
При n=1 х = 20. Такого элемента нет.
При n=2 х = 40. Это – кальций.
При n≥3 решений нет.
Искомое соединение – бромид кальция, CaBr2.
№3
Рассчитайте относительную молекулярную массу углекислого газа по системе Берцелиуса, в которой атомная масса кислорода была принята равной 100 единицам.
Решение
Пусть молекулярная масса СО2 в системе Берцелиуса равна х. Так как отношение молекулярных масс не зависит от выбора единиц измерения, то можно записать соотношение:
44:16 = х:100. Тогда х = 275.
№4
Простое вещество, молекула которого имеет массу 1,18·10–22 г, вступает в реакции с железом, водородом, фосфором и водой. Определите и назовите данное простое вещество. Напишите уравнения упомянутых химических реакций и укажите условия их протекания.
Решение
Молярная масса простого вещества равна: М = m·NA = 1,18·10–22·6,02·1023 = 71 (г/моль). Это – хлор (Cl2).
Реакции, о которых говорится в условии задачи:
3Cl2 + Fe = 2FeCl3 (нагревание)
Cl2 + H2 = 2HCl (освещение или катализатор)
5Cl2 + 2P = 2PCl5 (обычные условия)
Cl2 + H2O = HCl + HClO (обычные условия).
№6
Определите количество вещества воды, которое приходится на 1 моль соли в 10%-ном растворе сульфата меди (II).
Решение
Предположим, что взято 100 г раствора. Он содержит 10 г CuSO4 и 90 г воды. Эти массы соответствуют 10:160 = 0,0625 моль CuSO4 и 90:18 = 5 моль Н2О. Отношение n(CuSO4):n(H2O) = 5: 0,0625 = 80. То есть в растворе на каждый моль CuSO4 приходится 80 моль воды.
№7
Завершите уравнения химических реакций. Назовите продукты этих реакций.
? + ? = HF
? + ? = HF + ?
H2 + N2 = ?
H2 + ? = Cu + ?
? = O3
Ba + ? = Ba(OH)2 + ?
? + ? = CaBr2
Na2O + ? = Na2SiO3
P + O2 = ?
(CuOH)2CO3 = ? + ? + ?
Решение
H2 + F2 = 2HF фтороводород
СaF2 + H2SO4 = 2HF + CaSO4 фтороводород, сульфат кальция
3H2 + N2 = 2NH3 аммиак
H2 + CuO = Cu + H2O медь, вода
3O2 = 2O3 озон
Ba + 2H2O = Ba(OH)2 + Н2 гидроксид бария, водород
Ca + Br2 = CaBr2 бромид кальция
Na2O + SiO2 = Na2SiO3 силикат натрия
4P + 5O2 = 2P2O5 оксид фосфора(V)
(CuOH)2CO3 = CuO + CO2 + H2O оксид меди(II), диоксид углерода, вода.
