
- •Лабораторная работа №3 Электролитическая диссоциация растворов и расплавов. Реакции ионного обмена
- •Определение кислот, оснований и солей дается с точки зрения теории электролитической диссоциации
- •Понятие об активности ионов
- •Произведение растворимости электролитов
- •Примеры решения задач
- •Опыт 1. Определение электрической проводимости некоторых веществ
- •Опыт 2. Ионная реакция с образованием осадка
- •Опыт 4. Ионная реакция с образованием малодиссоциирующего вещества
- •Вопросы и задания для самоподготовки
Опыт 1. Определение электрической проводимости некоторых веществ
Необходимо определить электропроводность ряда растворов. Для этого пользуются прибором приведенном на рисунке 10.
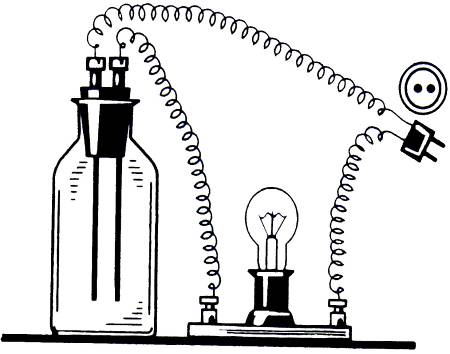
Рисунок 10. Прибор для определения электропроводности растворов
В стакан вместимостью 100 мл налейте примерно 50 мл (на стакане сделайте метку, чтобы каждый раз не измерять объем) дистиллированной воды, опустите электроды, не допуская их замыкания и включите ток. Проводит ли вода ток? Выключите прибор, внесите в воду немного сахара. Является ли сахар электролитом? Пропускает ли раствор сахара ток?
Выключите прибор, промойте стакан и электроды дистиллированной водой. Наполните стакан такой же водой до метки. К воде прибавьте небольшое количество поваренной соли и включите прибор. Что наблюдается? Прибор выключите, угольные электроды высушите фильтровальной бумагой, опустите в сухую поваренную соль и включите прибор. Что наблюдается? Почему сухая соль не проводит ток?
В стакане с меткой затем испытайте электропроводность растворов серной кислоты, едкого натра, сульфата меди и сделайте вывод об их электропроводности и активности. Напишите уравнение электролитической диссоциации взятых электролитов. Какие из них диссоциируют ступенчато?
Опыт 2. Ионная реакция с образованием осадка
В пробирку налейте 1 мл раствора хлорида бария и добавьте 1 мл серной кислоты. Что наблюдаете? Напишите уравнения реакций в молекулярной и ионной формах и, используя значение произведения растворимости, объясните полученный результат.
Опыт 3. Ионная реакция с образованием слабого электролита
В пробирку к нескольким кристалликам хлорида аммония прилейте раствор гидроксида натрия. Пробирку слегка нагрейте. Определите выделяющийся газ по запаху. Напишите уравнение реакции в молекулярной и ионной формах.
Опыт 4. Ионная реакция с образованием малодиссоциирующего вещества
В пробирку налейте 1 мл раствора азотной кислоты, несколько капель фенолфталеина и добавьте 1 мл раствора гидроксида калия. Что наблюдаете? Напишите уравнения реакции в молекулярной и ионной формах.
Опыт 5. Ионная реакция с образованием комплексного соединения
К 1 мл раствора медного купороса прибавьте такой же объем едкого натра. К выпавшему голубому осадку прибавьте по каплям раствор аммиака. Образуется аммиакат меди, содержащий комплексный катион [Cu(NH3)4]2+ синего цвета. Напишите уравнение реакции в молекулярной и ионной формах.
Вопросы и задания для самоподготовки
1. В чем сущность теории электролитической диссоциации?
2. Какие вещества называют электролитами? Чем отличаются их водные растворы от растворов неэлектролитов?
3. Что такое кислоты, основания и соли с точки зрения теории электролитической диссоциации?
4. Что такое степень электролитической диссоциации? От каких факторов она зависит?
На какие группы условно делят электролиты по величине степени их диссоциации? Приведите примеры представителей этих групп.
Что такое константа электролитической диссоциации? От каких факторов она зависит?
Чем обусловливается сила электролитов?
Как формулируется и математически выражается закон разбавления Оствальда?
Что называется произведением растворимости? Приведите примеры. От каких факторов оно зависит?
Как влияет введение в раствор одноименного иона на смещение ионного равновесия?
При каких условиях реакция между электролитами протекает до конца?
Составьте молекулярные и ионные уравнения образования малорастворимых веществ: ВаСrО4, Аg3PО4, СаСО3, Сu(ОН)2, Fе(ОН)3.
Вычислите константу диссоциации одноосновной слабой кислоты, если степень диссоциации ее в 0,1 н. растворе равна 1,32%.
Вычислите степень диссоциации муравьиной кислоты (НСООН) в 0,5 н. растворе, если известно, что концентрация ионов Н+ в нем равняется 0,1 моль/л.
Рассчитайте для сероводородной кислоты константу диссоциации первой ступени, если степень диссоциации в 0,1 н. растворе ее равна 0,007%.
Вычислите произведение растворимости Zn(ОН)2, если растворимость его равна
 .
.Произведение растворимости сульфида серебра равно 1,6·10-4. Рассчитайте растворимость этой соли в моль/л.
Пользуясь значениями произведения растворимости, определите, какое вещество и во сколько раз больше растворимо в воде - Fе(ОН)2 или Fе(ОН)3.
Константа диссоциации масляной кислоты С3Н7СООН равна
 .
.
Вычислить степень ее диссоциации в 0,005 М растворе.
Чему равна концентрация ионов водорода Н+ в водном растворе муравьиной кислоты, если α = 0,03?
Степень диссоциации уксусной кислоты СН3СООН в 0,2 н. растворе равна 0,03. Определить константу диссоциации кислоты и значение рК.
Растворимость СаСО3 при 350С равна
 моль/л. Вычислить произведение
растворимости этой соли.
моль/л. Вычислить произведение
растворимости этой соли.Вычислить произведение растворимости PbBr2 при 250С, если растворимость соли при этой температуре равна моль/л.
В 500 мл воды при 180С растворяется 0,0166 г АgСrО4. Чему равно произведение растворимости этой соли?
Для растворения 1,16 г PbI2 потребовалось 2 л воды. Найти произведение растворимости соли.
