
- •Лабораторная работа №3 Электролитическая диссоциация растворов и расплавов. Реакции ионного обмена
- •Определение кислот, оснований и солей дается с точки зрения теории электролитической диссоциации
- •Понятие об активности ионов
- •Произведение растворимости электролитов
- •Примеры решения задач
- •Опыт 1. Определение электрической проводимости некоторых веществ
- •Опыт 2. Ионная реакция с образованием осадка
- •Опыт 4. Ионная реакция с образованием малодиссоциирующего вещества
- •Вопросы и задания для самоподготовки
Лабораторная работа №3 Электролитическая диссоциация растворов и расплавов. Реакции ионного обмена
Электролитами называются вещества, растворы и расплавы которых проводят электрический ток. Электролиты являются проводниками второго рода. Причины прохождения электрического тока в растворах и расплавах связаны с наличием в них ионов. К электролитам относятся вещества с ионной и ковалентной полярной связью. Электролитами являются кислоты, основания, соли.
Распад молекул растворенного вещества на ионы приводит к увеличению общего числа частиц в растворе электролита, что обусловливает существенное различие между свойствами растворов электролитов и неэлектролитов.
В 1887 году шведский химик С. Аррениус создал теорию электролитической диссоциации, которая позволила объяснить электропроводность электролитов и особенности свойств их растворов. Электролитической диссоциацией называется распад вещества в водных растворах или в расплавах на ионы.
Основные положения теории электролитической диссоциации:
1. В растворах молекулы растворенного вещества распадаются – диссоциируют на положительно заряженные (катионы) и отрицательно заряженные (анионы) ионы.
2. На процесс диссоциации влияет природа растворителя. Только полярные растворители вызывают распад вещества на ионы. Примеры таких растворителей: вода, аммиак. Диполи растворителя, орентируясь вокруг частиц растворенного вещества, разрушают кристаллическую решетку и тем самым высвобождают ионы, расположенные в узлах решетки.
3. Диссоциация – обратимый процесс. Наряду с распадом молекул на ионы происходит их взаимодействие – ассоциация:
HCI H+ + CI-
NaCI Na+ + CI-
4. Образующиеся в результате диссоциации ионы в растворе находятся в хаотическом движении. Если в раствор погрузить электроды и приложить к ним электрическое напряжение, то положительно заряженные ионы направляются к отрицательному электроду – катоду, соответственно эти ионы называются катионами, а отрицательно заряженные частицы перемещаются к положительному электроду – аноду и соответственно называются анионами.
Определение кислот, оснований и солей дается с точки зрения теории электролитической диссоциации
Кислотами называют электролиты, которые при диссоциации образуют в качестве катионов только ионы водорода, а в качестве анионов – кислотные остатки. Например:
HCI H+ + CI-
CH3COOH↔H+ + CH3COO-
Двух- и многоосновные кислоты диссоциируют ступеньчато с отрывом одного иона водорода Н+. Например:
Н2SО4 ↔ Н+ + НSО4- (первая ступень)
НSО4- ↔ Н+ + SО42- (вторая ступень)
Н2SО4 ↔ 2Н++ SО42-
Н3PО4 ↔ Н+ + Н2PО4- (первая ступень)
Н2PО4- ↔ Н+ + НPО42- (вторая ступень)
НPО42- ↔ Н+ + PО43- (третья ступень)
Н3PО4 ↔3Н+ + PО43-
Основаниями называют электролиты, которые при диссоциации образуют в качестве анионов только гидроксид-ионы, а в качестве катионов ионы металлов. Например:
NaОН ↔ Na+ + ОН-
Двух- и многокислотные основания диссоциируют ступеньчато с отрывом одного гидроксид-иона. Например:
Са(ОН)2 ↔ Са(ОН)+ + ОН- (первая ступень)
Са(ОН)+ ↔ Са2+ + ОН- (вторая ступень)
Са(ОН)2 ↔ Са2+ + 2ОН-
Солями называют электролиты, которые при диссоциации образуют катионы металлов(сюда относят и катион аммония NН4+) и анионы кислотных остатков. Например:
NaСl ↔ Na+ + Сl-
К3PО4 ↔ 3 К+ + PО43-
кислые соли: КНSО4 ↔ К+ + НSО4- Na2НPО4 ↔ 2Na+ + НPО42-
НSО4- ↔ Н+ + SО42- НPО42- ↔ Н+ + PО43-
основные соли: Mg(OH)Cl ↔ Mg(OH)+ + Cl- Аl(ОН)2Cl ↔ Аl(ОН)2+ + Cl-
Mg(OH)+ ↔ Mg2+ + OH- Аl(ОН)2+ ↔ Аl(ОН)+ + ОН-
Аl(ОН)+ ↔ Аl3+ + ОН-
двойные соли: КАl(SО4)2 ↔ К+ + Аl3+ + 2 SО42-
(NН4)2Fе(SО4)2 ↔ 2 NН4+ + Fе2+ + 2 SО42-
Ионы по своим свойствам отличаются от нейтральных атомов. Например, если металлический натрий Na при попадании в организм животного вызывает сильный ожог окружающих тканей, то катионы натрия Na+ регулируют осмотическое давление в живом организме.
Количественной характеристикой силы электролита является степень электролитической диссоциации α, которая равна отношению количества молекул, распавшихся на ионы, к общему числу молекул растворенного вещества в растворе.
 или
или

где
 –
количество
молекул, распавшихся на ионы;
–
количество
молекул, распавшихся на ионы;
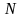 –
общее
число молекул растворенного вещества
в растворе.
–
общее
число молекул растворенного вещества
в растворе.
В зависимости от степени диссоциации все электролиты делятся на сильные, средней силы и слабые.
К сильным электролитам относятся электролиты, степень электролитической диссоциации которых больше 30% (α >30%). Сильными электролитами являются многие неорганические соли, некоторые кислоты, например Н2SО4, HCl, НNО3, НClО4, гидроксиды щелочных и щелочноземельных металлов, например: NaОН, КОН, Ва(ОН)2 и др.
Если α < 3%, то электролиты относятся к слабым электролитам. Все амфотерные гидроксиды, кислоты СН3СООН, Н2СО3, вода Н2О – слабые электролиты.
Электролиты, степень электролитической диссоциации которых находится в пределах α = 3-30%, относятся к электролитам средней силы. Кислоты Н3PО4 и Н2SО3 – электролиты средней силы.
Чем больше степень диссоциации, тем сильнее соответствующая кислота, соль или основание. Свойства растворов сильных электролитов определяются преимущественно ионной формой частиц, поэтому диссоциацию сильных электролитов можно представить как односторонний процесс (полный распад вещества на ионы).
На степень электролитической диссоциации оказывают влияние следующие факторы:
1. Природа растворителя. Это связано с величиной диэлектрической проницаемости ε. Для воды ε = 80,4, а для бензола ε = 2,3.
Как следует из закона Кулона, сила (f) электростатического притяжения двух разноименно заряженных частиц зависит не тоько от величины их зарядов (е1 и е2), расстояния между ними r, но и от природы среды, в которой взаимодействуют заряженные частицы, т.е. от ε:
![]()
Так, притяжение ионов в воде в 80,4 раза слабее, чем в вакууме, а хлороводород хорошо диссоциирует в воде и практически не диссоциирует в бензоле.
2. Природа растворенного вещества. Различные вещества в воде диссоциируют по-разному, например, соляная кислота во много раз лучше, чем уксусная; сахар, хорошо растворяясь в воде, вовсе не диссоциирует на ионы (α = 0).
3. Температура. У сильных электролитов с повышением температуры степень диссоциации уменьшается, у слабых проходит через максимум (в области 600С).
4. Концентрация раствора. С увеличением концентрации раствора степень диссоциации уменьшается, как это следует из принципа Ле-Шателье.
5. Наличие одноименных ионов. Добавление одноименных ионов уменьшает степень диссоциации, что также согласуется с принципом Ле-Шателье.
В растворе слабого электролита существует химическое равновесие между молекулярной и ионной формами вещества. Количественной характеристикой любого химического равновесия является константа равновесия, которая по отношению к процессу электролитической диссоциации называется константой диссоциации Кд. Например, для азотистой кислоты:
НNО2 ↔ Н+ + NО2-

Для хорошо растворимых сильных электролитов характеризовать диссоциацию с помощью константы диссоциации не имеет смысла, так как при полном распаде молекул на ионы эта величина будет стремиться к бесконечным значениям. По отношению к малорастворимым сильным электролитам константу равновесия используют для оценки растворимости вещества. Чем больше константа диссоциации, тем сильнее электролит. Константа диссоциации завистит только от температуры и природы растворителя.
Между константой и степенью диссоциации существует определенная зависимость, которую установил Оствальд, изучавший поведение разбавленных растворов электролитов. Математически это соотношение выражается формулами:
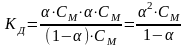 ;
;

Для
слабых электролитов, у которых
 ,
,
 ,
отсюда:
,
отсюда:

Полученная формула называется законом разбавления Оствальда. Из этого закона следует, что при разбавлении раствора слабого электролита степень его диссоциации увеличивается.
