
- •О.Б.Чалова, а.М. Сыркнн Химические свойства металлов
- •Рецензенты
- •Введение
- •1. Деление элементов на металлы и неметаллы.
- •1.1. Периодические свойства атомов и ионов
- •1.2. Деление элементов на металлы и неметаллы.
- •1.3. Классификация простых веществ по составу
- •Неметалл
- •2. Металлическая химическая связь. Металлические структуры
- •2.1. Упрощенная модель металлической химической связи
- •2.2. Резонанс ковалентных связей в металлах.
- •2.3. Зонная теория проводимости. Зонные структуры в металлах
- •2.4. Металлические структуры
- •2.5. Поликристаллическая структура металлов
- •2.6. Сплавы и интерметаллические соединения металлов
- •2.6.2. Интерметаллические соединения.
- •3. Физические свойства металлов
- •3.2. Поляризуемость.
- •3.3. Температура плавления, температура кипения металлов.
- •3.4. Электропроводность.
- •3.5. Теплопроводность.
- •3.6. Магнитные свойства.
- •3.7. Механические свойства.
- •3.8. Сверхпроводимость.
- •3.9. Контактные потенциалы
- •3.10. Работа выхода электрона.
- •4. Химические свойства металлов
- •4.1. Общие тенденции изменения химической активности металлов.
- •4.2. Взаимодействие металлов с неметаллами
- •4.2.1. Общие тенденции изменения окислительной способности неметаллов
- •4.2.2. Взаимодействие металлов с галогенами
- •4.2.3. Взаимодействие металлов с кислородом
- •4.2.4. Взаимодействие металлов с халькогенами
- •4.2.5. Взаимодействие металлов с азотом и фосфором
- •4.2.6. Взаимодействие металлов с углеродом, кремнием, водородом
- •5. Взаимодействие металлов с водными растворами окислителей
- •5.1. Ряд стандартных окислительно-восстановительных потенциалов металлов
- •5.2. Взаимодействие металлов с водой
- •5.3. Взаимодействие металлов с водными растворами щелочей
- •5.4. Взаимодействие металлов с растворами кислот, окисляющими
- •5.5. Взаимодействие металлов с концентрированной серной кислотой
- •5.6. Взаимодействие металлов с азотной кислотой
- •5.7. Взаимодействие металлов с «царской водкой» и другими смесями
- •5.8. Взаимодействие металлов с растворами солей
- •5.8.1. Окисление катионом неактивного металла в растворах солей.
- •5.8.2. Окисление металлов в растворах солей, подвергающихся гидролизу по катиону
- •5.8.3. Окисление металлов в растворах солей, подвергающихся гидролизу по аниону
- •5.8.4. Окисление металла растворенным кислородом.
- •5.8.5. Окисление металла в растворах, содержащих анионы – лиганды.
- •5.8.6. Взаимодействие металлов с растворами аммиака
- •6. Экспериментальная часть
- •6.1. Общие рекомендации для подготовки к лабораторным занятиям
- •Лабораторная работа №_____ Тема:________________________________________________
- •6.2. Основные правила безопасной работы в химической лаборатории
- •Библиографический список
- •Содержание
- •Учебное издание
- •Химические свойства металлов Редактор л.А.Маркешина
- •Тираж 600 экз. Заказ .
- •450062, Республика Башкортостан, г.Уфа, ул. Космонавтов, 1
2.6.2. Интерметаллические соединения.
Сплавляемые металлы могут образовывать между собой химические соединения – интерметаллиды. Например, в бронзе – сплаве на основе Cu и Sn, содержащем также Al, Be, Pb, присутствует интерметаллическое соединение состава Cu3Sn. В латуни – сплаве на основе Cu и Zn, содержащем также Al, Fe, Mn - интерметаллид CuZn3. Важнейшей составной частью стали является карбид железа Fe3C (цементит). Состав интерметалидов обычно не отвечает стехиометрической валентности элементов. Интерметаллиды – это нестехиометрические соединения, составляющие обширный класс неорганических веществ. Формулы этих соединений указывают лишь на то, что для кристаллических решеток характерно определенное соотношение компонентов, например в Fe3C на каждые три атома железа приходится один атом углерода.
В противоположность твердым растворам интерметаллические соединения, как правило, имеют сложную кристаллическую структуру, отличную от структур исходных металлов. Свойства интерметаллидов также существенно отличаются от свойств исходных компонентов (таблица 6). Так, в обычных условиях интерметаллиды уступают чистым металлам по электрической проводимости и теплопроводности, но превосходят их по твердости и температуре плавления. Например:
Таблица 6. Сравнение свойств интерметаллида и металлов.
Свойство |
Mg |
β - Sn |
Mg2Sn |
Т. пл., оС |
650 |
232 |
778 |
Электрическая проводимость* |
21 |
8 |
0,1 |
Ширина запрещенной зоны, эВ |
- |
- |
0,34 |
* - электрическая проводимость ртути принята за единицу
Все это показывает, что интерметаллиды можно рассматривать как соединения со смешанной межатомной связью (металлической, ковалентной и ионной). При этом в разных интерметаллидах относительная доля того, или иного типа связи, меняется в широких пределах.
При преимущественном проявлении металлической связи состав интерметаллидов и их структуру можно определить исходя из значений электронных концентраций. Так, для ряда интерметаллидов с кубической объемно центрированной структурой электронная концентрация равна 1,5, с гексагональной структурой — 1,75.
В качестве примера рассмотрим, при каких сочетаниях числа атомов меди и цинка возникает интерметаллид с объемно центрированной кубической или гексагональной структурой.
Поскольку медь (4s1) имеет один внешний, а цинк (4s2) два внешних валентных электрона, электронная концентрация 1,5 возможна лишь для соединения среднего состава CuZn (т. е. когда на два атома приходится три валентных электрона). Электронная концентрация 1,75 возникает при составе интерметаллида CuZn3 (на четыре атома приходится семь валентных электронов).
Таким же образом можно показать, что объемно центрированную решетку имеют соединения состава AgZn, AgMg, Cu3Al, Cu5Sn, а гексагональную решетку — Ag5Cl3, Ag13Sb3, Cd3Li, Cu3Si.
Однако для большинства интерметаллических соединений, в особенности для d-элементов, закономерности более сложны и теоретически предсказать изложенным способом их состав и структуру невозможно.
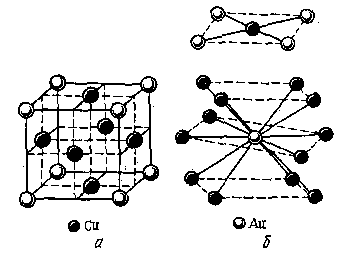
Рис. 17. Кристаллическая решетка Cu3Au (а) и взаимная
координация атомов в кристалле (б)
Сведения о составе и структуре интерметаллидов обычно получают экспериментально. На рис. 17, а показана кристаллическая решетка Cu3Au. Атомы золота занимают вершины куба, а атомы меди располагаются в центре граней. Следовательно, каждый атом золота находится в координации с 12 атомами меди, а каждый атом меди — с 4 атомами золота (рис. 17, б), что отвечает средней формуле Cu3Au.
Разнообразие типов химической связи и кристаллических структур обусловливает у интерметаллических соединений широкий спектр физико-химических, электрических, магнитных, механических и других свойств. Так, их электрические свойства могут иногда изменяться от сверхпроводимости в жидком гелии до полупроводимости при обычных условиях.
Своеобразны механические свойства интерметаллидов, весьма чувствительные к воздействию температур. При обычных условиях большинство из них очень твердые и хрупкие. При температуре же, составляющей 70—90% от их температуры плавления, интерметаллиды ведут себя как пластичные тела. Основная причина этого — возрастание доли металлической связи при нагревании.
Многие интерметаллические соединения отличаются высокой теплотой образования и химической стойкостью.
Интерметаллиды в воде не растворяются, но некоторые из них (подобно некоторым металлам) способны растворяться в неводных растворителях, в частности в жидком аммиаке. При взаимодействии металлов в неводных растворителях, например в жидком аммиаке, получаются интерметаллиды:
4Na + 9Pb = Na4Pb9 (зеленый раствор)
3Na + 7Sb = Na3Sb7 (красный раствор)
3Na + 7Bi = Na3Bi7 (коричневый раствор)
В неводных растворителях они ведут себя как электролиты, то есть при растворении дают ионы, вступают в реакции обмена:
2Ca(NO3)2 + K4Pb = Ca2Pb + 4KNO3
4Zn(CN)2 + 10Na = 2NaZn4 + 8NaCN
При электролизе растворов или расплавов интерметаллидов относительно более электроотрицательный металл выделяется на аноде, а более электроположительный — на катоде. Например, при электролизе аммиачного раствора Na4Pb9 на катоде выделяется натрий, на аноде — свинец. При электролизе расплава KNa2 калий выделяется на катоде, натрий — на аноде.
