
- •Дополнительная
- •Определение аналитической химии.
- •3). Классификация методов ах по природе анализируемых составных частей объекта:
- •4). По ходу анализа методы аналитической химии делятся на:
- •Классификация методов определения
- •5). Классификация методов ах по способу выполнения реакции.
- •6). Классификация ах по количеству анализируемого вещества.
- •Требования к методам аналитической химии.
- •Значение аналитической химии.
- •Лекция 2.
- •Равновесие в гомогенной системе.
- •Термодинамическая, концентрационная и условная константы равновесия. Связь между ними.
- •Связь между термодинамической и реальной константами
- •Применение органических реагентов в анализе.
- •Применение органических реагентов.
- •Хелаты.
- •Строение органических реагентов, способных образовывать внутрикомплексные соединения.
- •Комплексообразующие группы.
- •Солеобразующие группы
- •Устойчивость внутрикомплексных соединений.
- •Лекция 4 Окислительно-восстановительные потенциалы и их использование в анализе.
- •Факторы, влияющие на величину окислительно-восстановительного потенциала.
- •Влияние конкурирующей реакции осадкообразования на потенциал
- •Влияние конкурирующей реакции комплексообразования на величину окислительно-восстановительного потенциала.
- •Лекция 5 Буферные растворы
- •Механизм действия буферной системы
- •РН некоторых биологических жидкостей.
- •Расчёт рН буферного раствора
- •Способы выражения концентрации растворов.
- •Инструментальные методы анализа
- •Принципы аналитической оптической спектроскопии.
- •Молекулярный абсорбционный анализ
- •Пределы измерения оптической плотности
- •Методы установления подчинимости основному закону светопоглощения.
- •Методы определения концентрации вещества в растворе
- •Атомно – эмиссионная спектроскопия
- •Лекция 8 Атомно-абсорбционная спектроскопия
- •Способ атомизации.
- •Способы определения концентрации
- •Достоинства метода.
- •Недостатки метода.
- •Лекция 9 Потенциометрия
Значение аналитической химии.
- При анализе объектов с/х проводится агрохимический анализ: анализ почв, удобрений, самой с/х продукции.
- В науке биология. Анализ продуктов жизнедеятельности клеток – это аналитическая химия микромира. Выяснение природы белка – задача аналитиков, так как требуется выяснить какие аминокислоты входят в состав белка и в какой последовательности.
- Анализ пищевых продуктов. Определяются основные вещества (белки, жиры, углеводы, витамины, минеральные вещества), а также чужеродные компоненты (тяжелые металлы, канцерогены и др. токсичные вещества). 70% тяжёлых металлов (свинец, кадмий, ртуть и др.) попадают в организм с пищей.
- Охрана окружающей среды немыслима без контроля за степенью и характером загрязнения воды, почвы, воздуха. Проводится санитарно-химический анализ. Перечень веществ в воде на которые установлены ПДК включает 923 наименования. В России и многих других странах организована общегосударственная служба наблюдения и контроля уровня загрязнения объектов окружающей среды. В Уфе есть организация УГАК – Управление Государственного аналитического контроля
- В медицине проводится общий и биохимический анализ крови и по результатам анализа ставится диагноз.
- В фармацевтической промышленности ведут анализ лекарственных препаратов.
- В космических исследованиях проводят анализ породы луны, атмосферы Венеры. Это аналитическая химия макромира.
- В геологии проводят технический анализ. На основании анализа руд ведутся поиски полезных ископаемых.
- В криминалистике проводят судебно – химический анализ.
- В химии. Химический анализ – средство контроля производства и качества продукции в ряде отраслей народного хозяйства.
Лекция 2.
Теоретические основы аналитической химии.
Равновесие в гомогенной системе.
Большинство реакций в аналитической химии является обратимыми, поэтому мы имеем дело с равновесными системами и используем законы химического равновесия. При рассмотрении законов химического равновесия различают идеальную и реальную системы. В идеальной системе ионы и молекулы не испытывают воздействие со стороны других ионов и молекул (например, бесконечно разбавленные растворы), а в реальной системе ионы и молекулы испытывают действие со стороны окружающих их молекул и ионов (концентрированные растворы). Это приводит к кажущемуся увеличению или уменьшению концентрации ионов или молекул. Отклонение в поведении ионов от идеального чаще всего обусловлено электростатическим и побочным химическим взаимодействиями между ионами в растворе.
Для
учета влияния электростатического
взаимодействия концентрацию заменяют
на активность. Активность
– это эффективная концентрация ионов
соответственно которой они действуют
при химической реакции. Активность
связана с концентрацией следующим
выражением:
![]() ,
где
,
где
![]() -
коэффициент активности,
-
коэффициент активности,
[ ] – равновесная концентрация.
Коэффициент активности является мерой действия межионных сил и характеризует степень отклонения реальной системы от идеальной за счет электростатического взаимодействия ионов. Суммарное межионное взаимодействие характеризует ионная сила раствора.
![]() ,
где
,
где
![]() –
ионная
сила раствора,
–
ионная
сила раствора,
![]() -
заряд иона,
-
заряд иона,
![]() -
концентрация иона.
-
концентрация иона.
Ионная сила раствора характеризует напряженность электростатического поля, действующего на ионы в растворе.
Коэффициент
активности связан с ионной силой раствора
формулой Дебая и Гюккеля. Ограниченная
формула (
от 0,01 до 0,05 моль/л) выглядит так:
![]() ,
где
,
где
- коэффициент активности,
![]() -
заряд иона,
-
заряд иона,
– ионная сила раствора.
Д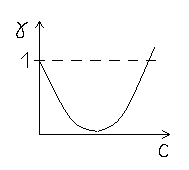 ля
более концентрированных растворов
(0,1-0,5 моль/л) формула усложняется:
ля
более концентрированных растворов
(0,1-0,5 моль/л) формула усложняется:
![]() .
.
Рис. 1. Зависимость коэффициента активности от концентрации.
При
увеличении ионной силы раствора
коэффициент активности уменьшается
(участок снижения кривой на рис. 1). На
участке повышения кривой концентрация
становится настолько высокой, что
происходит дегидратация, ионы освобождаются
от лишнего груза.
![]() в идеальном растворе, т. е. в бесконечно
разбавленном растворе сильных электролитов
или в растворах с низкой концентрацией
слабых электролитов. Расчетные значения
коэффициентов активности даны в
справочниках.
в идеальном растворе, т. е. в бесконечно
разбавленном растворе сильных электролитов
или в растворах с низкой концентрацией
слабых электролитов. Расчетные значения
коэффициентов активности даны в
справочниках.
