
Добавил:
Upload
Опубликованный материал нарушает ваши авторские права? Сообщите нам.
Вуз:
Предмет:
Файл:МОИ ЛЕКЦИИ АХ 2013.doc
X
- •Дополнительная
- •Определение аналитической химии.
- •3). Классификация методов ах по природе анализируемых составных частей объекта:
- •4). По ходу анализа методы аналитической химии делятся на:
- •Классификация методов определения
- •5). Классификация методов ах по способу выполнения реакции.
- •6). Классификация ах по количеству анализируемого вещества.
- •Требования к методам аналитической химии.
- •Значение аналитической химии.
- •Лекция 2.
- •Равновесие в гомогенной системе.
- •Термодинамическая, концентрационная и условная константы равновесия. Связь между ними.
- •Связь между термодинамической и реальной константами
- •Применение органических реагентов в анализе.
- •Применение органических реагентов.
- •Хелаты.
- •Строение органических реагентов, способных образовывать внутрикомплексные соединения.
- •Комплексообразующие группы.
- •Солеобразующие группы
- •Устойчивость внутрикомплексных соединений.
- •Лекция 4 Окислительно-восстановительные потенциалы и их использование в анализе.
- •Факторы, влияющие на величину окислительно-восстановительного потенциала.
- •Влияние конкурирующей реакции осадкообразования на потенциал
- •Влияние конкурирующей реакции комплексообразования на величину окислительно-восстановительного потенциала.
- •Лекция 5 Буферные растворы
- •Механизм действия буферной системы
- •РН некоторых биологических жидкостей.
- •Расчёт рН буферного раствора
- •Способы выражения концентрации растворов.
- •Инструментальные методы анализа
- •Принципы аналитической оптической спектроскопии.
- •Молекулярный абсорбционный анализ
- •Пределы измерения оптической плотности
- •Методы установления подчинимости основному закону светопоглощения.
- •Методы определения концентрации вещества в растворе
- •Атомно – эмиссионная спектроскопия
- •Лекция 8 Атомно-абсорбционная спектроскопия
- •Способ атомизации.
- •Способы определения концентрации
- •Достоинства метода.
- •Недостатки метода.
- •Лекция 9 Потенциометрия
Лекция 9 Потенциометрия
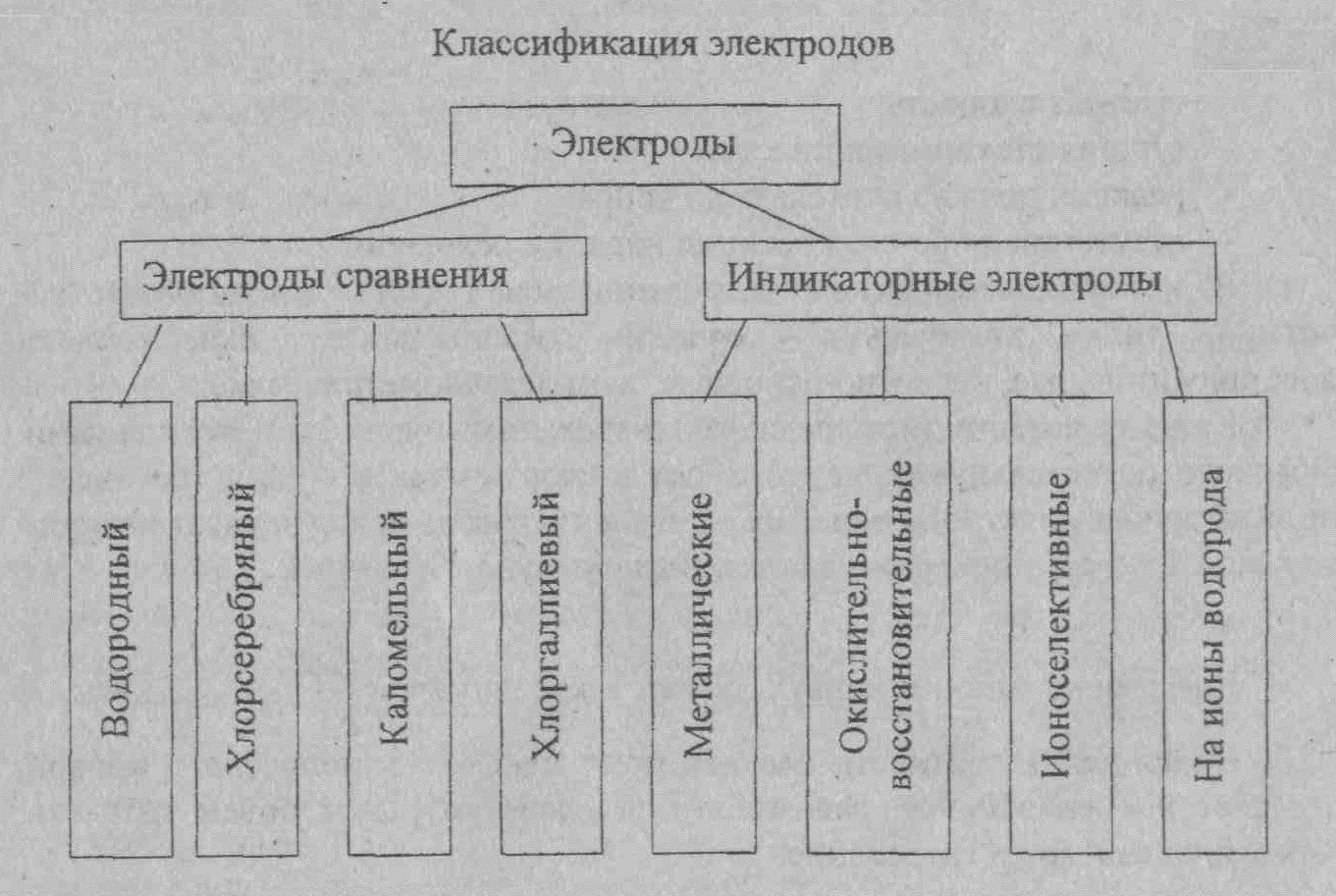
Хлорсеребряный электрод
Ag | AgCl | KCl
Каломельный электрод
Hg | Hg2Cl2 | KCl
Электрохимическая реакция – реакция на электроде
AgCl + e → Ag0 + Cl-
Потенциал хлорсеребряного электрода равен

aAgCl = 1
aAg = 1

Реакция в растворе Ag+ + Cl- → AgCl
Электрохимическая реакция на электроде Ag+ + e → Ag0↓
E = E0 + 0,059 lg C (Ag+)
Серебряный электрод можно применять для определения ионов серебра.
Для определения ионов ртути (I) нужен ртутный электрод.

Индикаторные электроды из благородных металлов (платина, золото, палладия) являются индикаторными для окислительно-восстановительных систем.

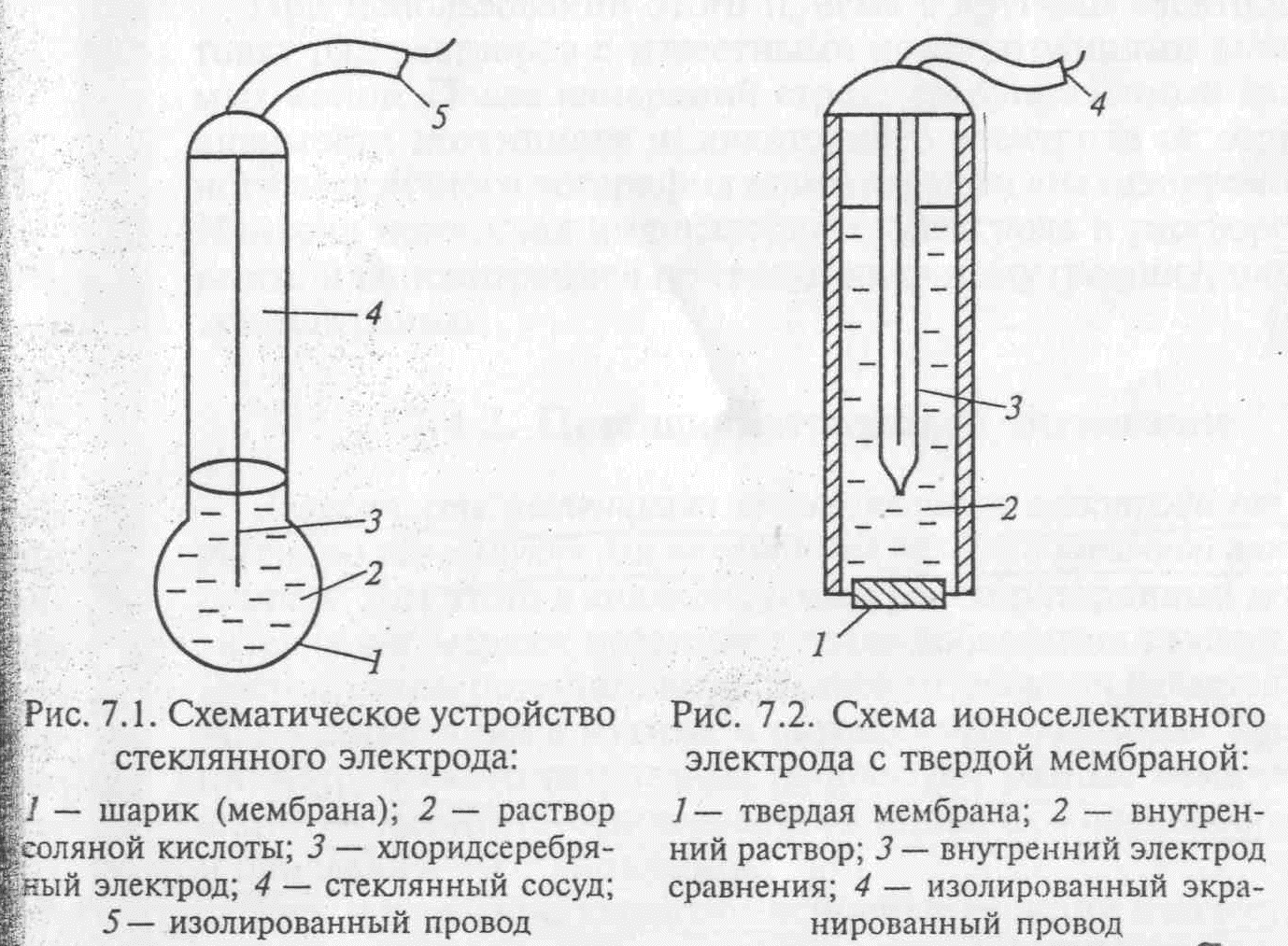
Потенциал ионоселективного электрода

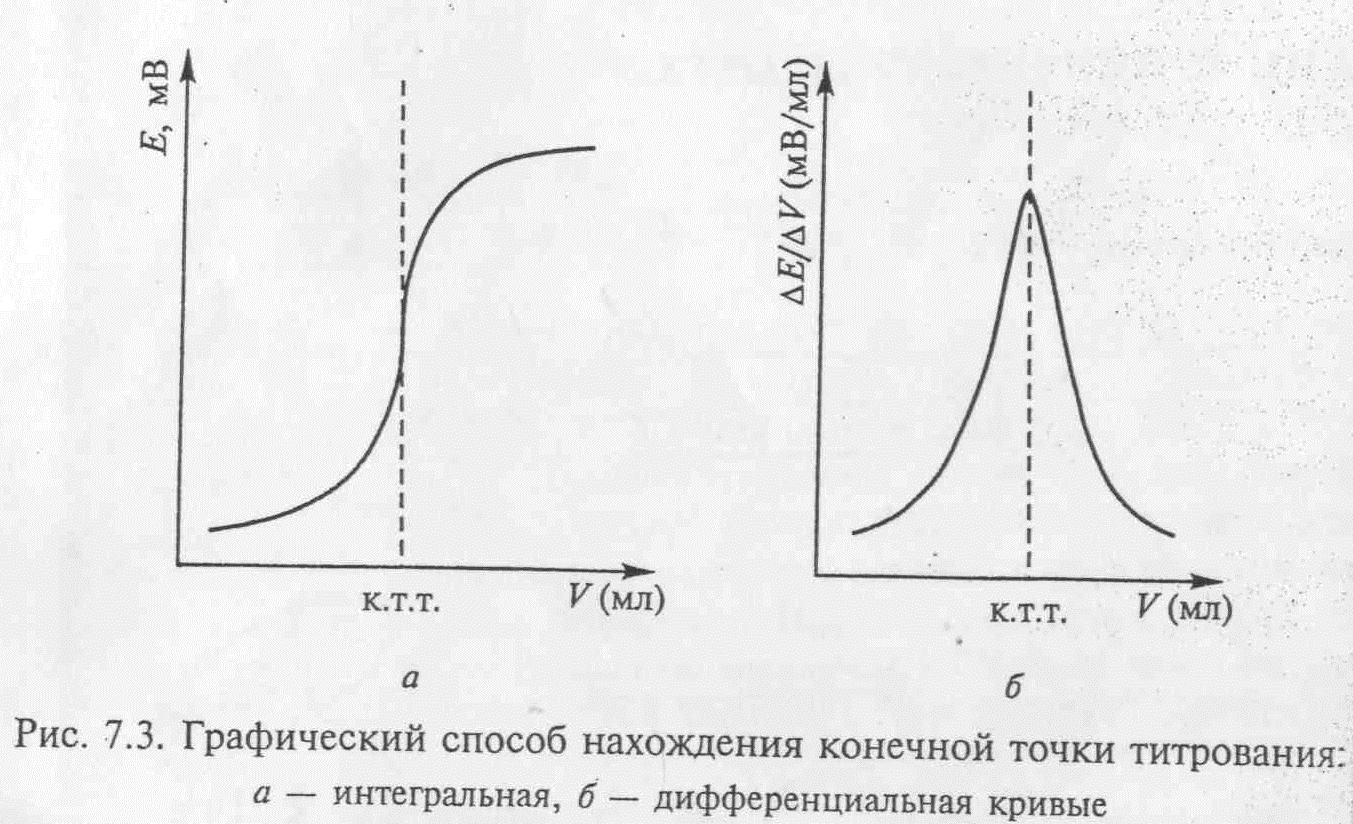
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
