
- •Дополнительная
- •Определение аналитической химии.
- •3). Классификация методов ах по природе анализируемых составных частей объекта:
- •4). По ходу анализа методы аналитической химии делятся на:
- •Классификация методов определения
- •5). Классификация методов ах по способу выполнения реакции.
- •6). Классификация ах по количеству анализируемого вещества.
- •Требования к методам аналитической химии.
- •Значение аналитической химии.
- •Лекция 2.
- •Равновесие в гомогенной системе.
- •Термодинамическая, концентрационная и условная константы равновесия. Связь между ними.
- •Связь между термодинамической и реальной константами
- •Применение органических реагентов в анализе.
- •Применение органических реагентов.
- •Хелаты.
- •Строение органических реагентов, способных образовывать внутрикомплексные соединения.
- •Комплексообразующие группы.
- •Солеобразующие группы
- •Устойчивость внутрикомплексных соединений.
- •Лекция 4 Окислительно-восстановительные потенциалы и их использование в анализе.
- •Факторы, влияющие на величину окислительно-восстановительного потенциала.
- •Влияние конкурирующей реакции осадкообразования на потенциал
- •Влияние конкурирующей реакции комплексообразования на величину окислительно-восстановительного потенциала.
- •Лекция 5 Буферные растворы
- •Механизм действия буферной системы
- •РН некоторых биологических жидкостей.
- •Расчёт рН буферного раствора
- •Способы выражения концентрации растворов.
- •Инструментальные методы анализа
- •Принципы аналитической оптической спектроскопии.
- •Молекулярный абсорбционный анализ
- •Пределы измерения оптической плотности
- •Методы установления подчинимости основному закону светопоглощения.
- •Методы определения концентрации вещества в растворе
- •Атомно – эмиссионная спектроскопия
- •Лекция 8 Атомно-абсорбционная спектроскопия
- •Способ атомизации.
- •Способы определения концентрации
- •Достоинства метода.
- •Недостатки метода.
- •Лекция 9 Потенциометрия
Молекулярный абсорбционный анализ
К молекулярному абсорбционному анализу относятся спектрофотометрия и фотоколориметрия.
Спектрофотометрия основана на поглощении строго монохроматического излучения, т.е. излучения определённой длины волны. Монохроматизация светового потока осуществляется с помощью кварцевых призм или дифракционных решёток, разлагающих белый свет в спектр. Измерения проводятся в широкой области длин волн от приблизительно 185 нм до приблизительно 1100 нм. При работе в УФ области, т.е. в области длин волн 200 – 400 нм в качестве источника света используют водородную или дейтериевую лампу, в видимой области – лампу накаливания. При работе в УФ области применяют кюветы из кварца, так как стекло поглощает УФ лучи. Приборы называются спектрофотометры.
Фотоколориметрия основана на поглощении света не строго монохроматического. Источником света служит лампа накаливания. Измерения проводят в видимой области спектра 400 – 750 нм. Свет от источника (лампы накаливания) проходит через светофильтры, которые пропускают излучение не определённой длины волны, а пропускают излучение шириной в несколько десятков нм – от 20 до 50. Приборы называются фотоэлектроколориметры.
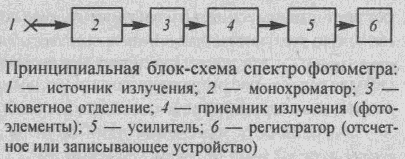
Методы анализа, основанные на измерении светопоглощения молекулами изучаемого вещества в видимой (185-400 нм) и УФ областях (400-760 нм) называют фотометрическими.
Для количественного определения вещества фотометрическим методом сначала переводят в соединение, поглощающее электромагнитное излучение, затем определяют ослабление интенсивности излучения при прохождении его через поглощающую среду определённой толщины, т.е. количественно определяют абсорбцию электромагнитного излучения.
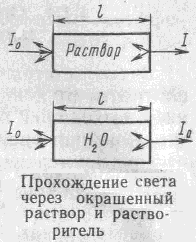
Если световой поток с интенсивностью I0 пропустить через кювету, наполненную окрашенным прозрачным раствором, часть света отразится от стенок кювета ( Iотр), часть света рассеивается от присутствующих в растворе взвешенных частиц ( Iрас ), часть света поглощается раствором (Iпогл), часть света проходит через раствор ( I) .
Интенсивность падающего излучения равна сумме составляющих:
I0 = Iотр + Iрас + Iпогл + I
Интенсивность светового потока, прошедшего через раствор, измеряют относительно раствора сравнения, при приготовлении которого растворитель и кюветы аналогичны применяемым для исследуемого раствора. Поэтому интенсивностями отраженного и рассеянного света можно пренебречь, так как они одинаковы для раствора сравнения и исследуемого раствора.
I0 = Iпогл + I
Интенсивность светового потока при прохождении через раствор уменьшается. Уменьшение интенсивности света при прохождении его через раствор подчиняется закону Бугера-Ламберта- Бера
I = I0 * 10-εlc
Графически это зависимость экспоненциальная, такими зависимостями пользоваться неудобно.

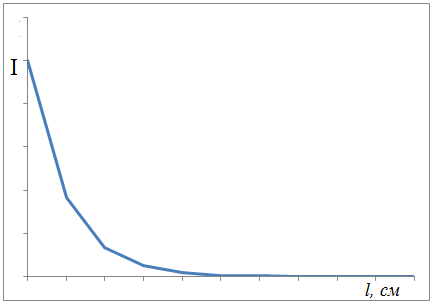
Поэтому уравнение было прологарифмировано.
Закон Бугера-Ламберта-Бера (закон светопоглощения)
А = ελсl, (3)
где А = Ig Io/I
Оптическая плотность – есть логарифм отношения интенсивности падающего на раствор света к интенсивности прошедшего через раствор света.
Оптическая плотность характеризует интенсивность света поглощенного веществом.
Оптическая плотность прямо пропорциональна концентрации и толщине поглощающего слоя.
ελ- молярный коэффициент светопоглощения
ελ.окрашенного соединения зависит от температуры, длины волны падающего света, но не зависит от концентрации и толщины поглощающего слоя.
Физический смысл ελ.:
ελ.представляет собой оптическую плотность одномолярного раствора при толщине поглощающего слоя один сантиметр.
ελ.характеризует чувствительность метода. Чем больше ελ., тем выше чувствительность определения, тем меньшую концентрацию можно определить данным методом. Нужно выбирать реакцию или реагент, который даёт раствор с наибольшим коэффициентом молярного поглощения. Зная ελ , можно рассчитать какую минимальную концентрацию можно определить фотоколориметрически.

т.е. фотоколориметрия очень чувствительный метод.
