
- •Дополнительная
- •Определение аналитической химии.
- •3). Классификация методов ах по природе анализируемых составных частей объекта:
- •4). По ходу анализа методы аналитической химии делятся на:
- •Классификация методов определения
- •5). Классификация методов ах по способу выполнения реакции.
- •6). Классификация ах по количеству анализируемого вещества.
- •Требования к методам аналитической химии.
- •Значение аналитической химии.
- •Лекция 2.
- •Равновесие в гомогенной системе.
- •Термодинамическая, концентрационная и условная константы равновесия. Связь между ними.
- •Связь между термодинамической и реальной константами
- •Применение органических реагентов в анализе.
- •Применение органических реагентов.
- •Хелаты.
- •Строение органических реагентов, способных образовывать внутрикомплексные соединения.
- •Комплексообразующие группы.
- •Солеобразующие группы
- •Устойчивость внутрикомплексных соединений.
- •Лекция 4 Окислительно-восстановительные потенциалы и их использование в анализе.
- •Факторы, влияющие на величину окислительно-восстановительного потенциала.
- •Влияние конкурирующей реакции осадкообразования на потенциал
- •Влияние конкурирующей реакции комплексообразования на величину окислительно-восстановительного потенциала.
- •Лекция 5 Буферные растворы
- •Механизм действия буферной системы
- •РН некоторых биологических жидкостей.
- •Расчёт рН буферного раствора
- •Способы выражения концентрации растворов.
- •Инструментальные методы анализа
- •Принципы аналитической оптической спектроскопии.
- •Молекулярный абсорбционный анализ
- •Пределы измерения оптической плотности
- •Методы установления подчинимости основному закону светопоглощения.
- •Методы определения концентрации вещества в растворе
- •Атомно – эмиссионная спектроскопия
- •Лекция 8 Атомно-абсорбционная спектроскопия
- •Способ атомизации.
- •Способы определения концентрации
- •Достоинства метода.
- •Недостатки метода.
- •Лекция 9 Потенциометрия
Инструментальные методы анализа
Классификация физико-химических методов анализа.
Наибольшее практическое значение имеют следующие методы:
1). Электрохимические
2) Оптические.
3). Хроматографические.
4). Радиометрические.
5). Масс-спектометрические методы анализа.
1). Электрохимические методы анализа основаны на измерении электрохимических свойств системы (электрической проводимости потенциалов и др. свойств анализируемых веществ). К ним относятся следующие методы:
а). Электрогравиметрический метод, основанный на измерении массы анализируемого вещества, которая выделяется на электроде при прохождении электрического тока через исследуемый раствор;
б). Кондуктометрический метод, основанный на электропроводности раствора;
в). Потенциометрический метод, основанный на измерении потенциала электрода, погружённого в раствор анализируемого вещества;
г). Полярографический метод, основанный на изучении кривых зависимости силы тока от напряжения;
д). Кулонометрический метод, основанный на измерении количества электричества, протекающего через раствор за счёт электрохимического превращения исследуемого вещества на электроде во время электролиза.
2). Оптические методы анализа основаны на измерении различных эффектов при взаимодействии анализируемого вещества с электромагнитным излучением, К ним относятся следующие методы:
а). Атомно-эмиссионный спектральный анализ, основанный на измерении длины волны, интенсивности и др. характеристик света, излучаемого возбужденными газообразными атомами;
б). Атомно-абсорбционный анализ, основанный на измерении поглощения резонансного излучения свободными атомами, находящимися в газовой фазе;
в). Спектрофотометрический метод, основанный на поглощении излучения молекулами в видимой и ультрафиолетовой областях;
г). Люминисцентный анализ, основанный на испускании излучения, подвергающихся облучению ультрафиолетовым светом.
3). Хроматографические методы анализа основаны на различном распределении анализируемого вещества между двумя фазами: подвижной и неподвижной.
4). Радиометрические методы анализа основаны на измерении радиоактивных свойств веществ.
5). Масс-спектрометрические методы анализа основаны на изучении ионизированных фрагментов (осколков) веществ.
Принципы аналитической оптической спектроскопии.
Современная спектроскопия базируется на квантовой теории, согласно которой частица вещества (атом, молекула может находиться только в определённых стационарных состояниях, которым отвечает некоторая дискретная последовательность энергии (энергетических уровней). Состояние с минимальной энергией называют основным, а все остальные состояния – возбуждёнными. Переход частицы из одного стационарного состояния в другое сопровождается испусканием или поглощением кванта электромагнитного излучения – фотона.
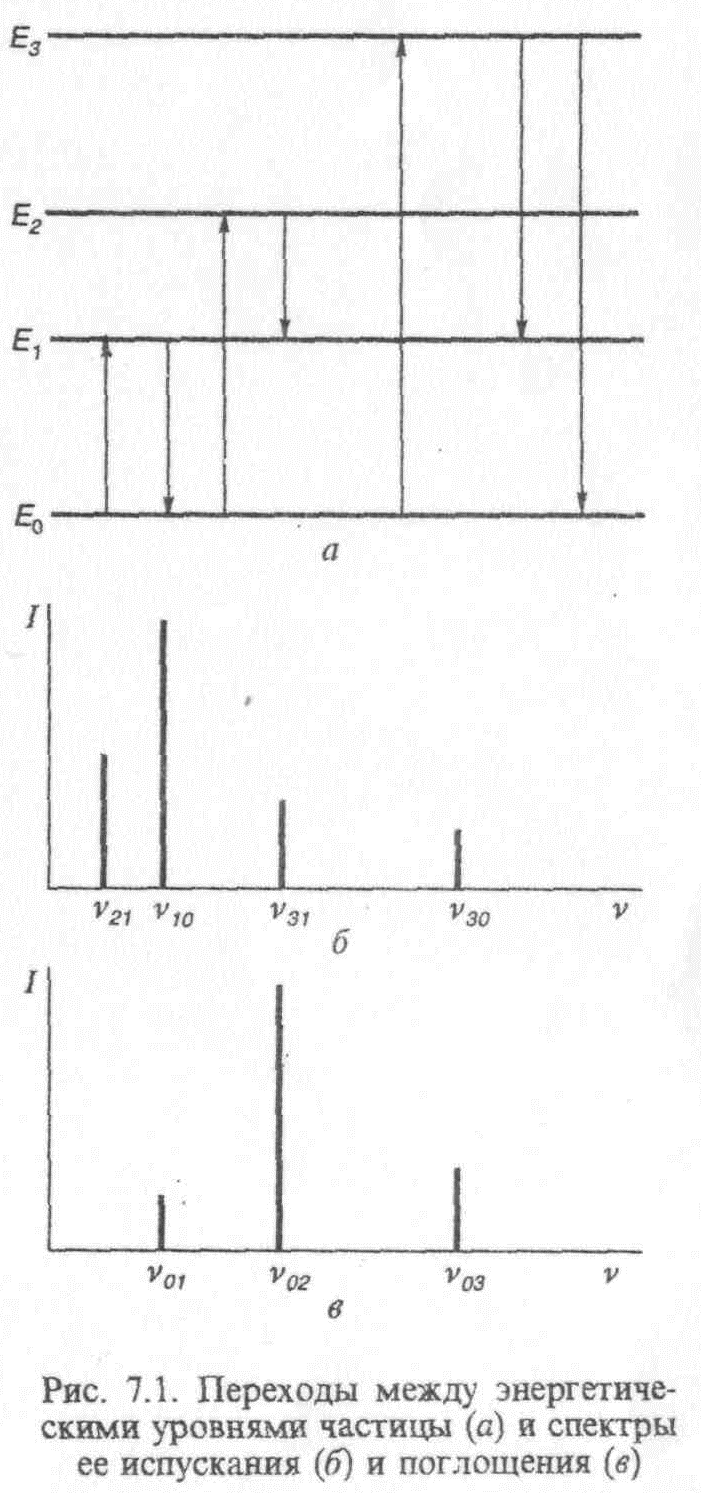
На рисунке представлена схема переходов между различными состояниями частицы. Горизонтальные линии соответствуют уровням энергии различных состояний: Ео – уровень энергии основного состояния; Е1, Е2, Е3 – уровни возбуждённых состояний в порядке возрастания их энергии. Стрелки, направленные вниз, соответствуют испусканию, а стрелки, направленные вверх – поглощению фотона.
Каждому переходу соответствует монохроматическая спектральная линия определённой частоты (длины волны) и интенсивности.
В спектроскопии вместо частоты ν используют волновое число ΰ = 1/λ, также называемое частотой (тильда над ν обычно опускается). Волновое число принято измерять в обратных сантиметрах (см-1), а длину волны в нанометрах (нм).
Совокупность спектральных линий, принадлежащих данной частице, называют её спектром. Спектры, испускаемые термически возбужденными частицами, называют эмиссионными.
Линии, возникающие в результате переходов в основное или из основного состояния, и соответствующие переходы называют резонансными.
Спектры, расположенные в оптическом диапазоне шкалы электромагнитных волн, называют оптическими. Оптический диапазон обычно подразделяют на ультрафиолетовую (УФ), видимую и инфракрасную (ИК) спектральные области. В свою очередь УФ область делится на дальнюю, или вакуумную, и ближнюю, а ИК область – на ближнюю, среднюю, или фундаментальную, и дальнюю зоны. В таблице 7.1 указаны границы этих областей.
Оптический диапазон шкалы электромагнитных волн
Спектральная область |
ν, см-1 |
λ, нм |
УФ Вакуумная (дальняя) Ближняя Видимая ИК ближняя средняя (фундаментальная) дальняя |
1,33∙104 - 4∙103
4∙103 – 200 200 - 20 |
10 – 200 200 – 400 400 – 750
|
В каждой области оптического диапазона пользуются своими, наиболее удобными для измерения единицами. В ИК области пользуются исключительно единицами частот. В УФ и видимой областях обычно используют единицы длин волн.
Спектры атомов в УФ, видимой и ближней ИК областях возникают при переходах внешних (валентных) электронов из одних энергетических состояний в другие и в целом удовлетворительно описываются схемой, приведённой на рис.7.1 Отличительной особенностью атомных спектров является их линейчатая структура. Спектры атомов состоят из большого числа дискретных спектральных линий, объединяемых в отдельные спектральные серии. (линейчатый спектр ││││ ││ ││ ). Положение линий в переделах каждой серии подчиняется определённым закономерностям, характерным для атомов каждого элемента. Исследуя атомные спектры образца, можно установить наличие в нём тех или иных химических элементов.
Спектры молекул значительно сложнее спектров атомов, поскольку обусловлены не только электронными переходами, но и колебаниями атомных ядер в молекуле, а также вращательным движением самой молекулы как целого. Приближенно энергию молекулы Е можно представить в виде суммы электронной Ее, колебательной Еν и вращательной Еr энергией.
Е = Ее + Еν + Еr
По порядку величин эти виды энергии различаются весьма существенно: Ее >> Еν >> Еr . Качественная схема энергетических уровней двухатомной молекулы приведена на рис. Для простоты на ней изображены лишь два электронных уровня, а также относящиеся к ним колебательные и вращательные уровни.

Наибольшим различием энергий характеризуются электронные уровни. Колебательные уровни ν расположены значительно ближе друг к другу. Еще меньше разница в энергии вращательных уровней.
Е= Еэл+Евр+Екол
Здесь Евр – энергия вращения молекулы вокруг центра тяжести.
При изменении энергии электронов у молекулы одновременно изменяются колебательная и вращательная энергии и вместо электронных наблюдается электронно-колебательно-вращательные переходы. Поскольку их число весьма велико, то электронно-колебательно-вращательный спектр, обычно называемый электронным, принимает вид широких перекрывающихся полос в УФ, видимой и ближней ИК областях.
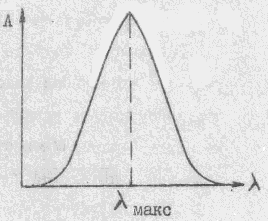
Молекулярные спектры чрезвычайно специфичны и широко применяются для идентификации веществ и исследования их структуры. (т.е. для качественного анализа)
