
- •Тема: Галогенпохідні вуглеводнів.
- •Хімічні властивості галогенпохідних алканів і. Реакції заміщення
- •Гідроліз
- •Алкоголіз (з алкоголятами або фенолятами – солями спиртів або фенолів) – реакція Вільямсона:
- •Амоноліз і аміноліз – взаємодія з амоніаком і амінами
- •Утворення тіолів і сульфідів
- •Іі. Реакції відщеплення (елімінування) – е-реакції
- •Ііі. Взаємодія з металами
- •Добування
- •Хімічні властивості
- •Ацетон (пропанон, диметилкетон) Галогенпохідні бензольного ряду (ароматичні галогенпохідні, галогенарени)
- •Методи добування
- •Фізичні властивості
- •Хімічні властивості
- •Ідентифікація галогенопохідних вуглеводнів
Іі. Реакції відщеплення (елімінування) – е-реакції
Супроводжуються відщепленням галогенводню від галогеналкану, при цьому утворюються алкени:

Від α атому Карбону відщеплюється галоген, а від сусіднього β атому Карбону відщеплюється Гідроген - такі реакції називаються - або 1,2-елімінуванням.
β α
C H3-CH2-Br + КОНсп.р-н СН2=СН2 + КBr + H2O
Загалом реакції відщеплення відбуваються за правилом Зайцева: Гідроген найлегше відщеплюється від найменш гідрогенізованого атома Карбону. Тобто повинні утворюватись найрозгалуженіші алкени (мають найбільшу кількість алкільних радикалів біля атому Карбону з подвійним зв’язком):
Н 3С
– СН – СН2
– СН3
+ КОНсп.р-н
Н3С
– СН = СН – СН3
+ KCl
+ H2O
3С
– СН – СН2
– СН3
+ КОНсп.р-н
Н3С
– СН = СН – СН3
+ KCl
+ H2O
│
Cl
СН3 СН3 СН3 СН3
 | | | |
| | | |
Н 3С – СН – С – СН2 – СН3 + КОНсп.р-н Н3С – С = С – СН2– СН3 + KBr + H2O
│
Br
За здатністю до реакцій відщеплення галогенводнів галогеналкани розміщуються в ряд:
R—I > R—Br > R—Cl > R—F
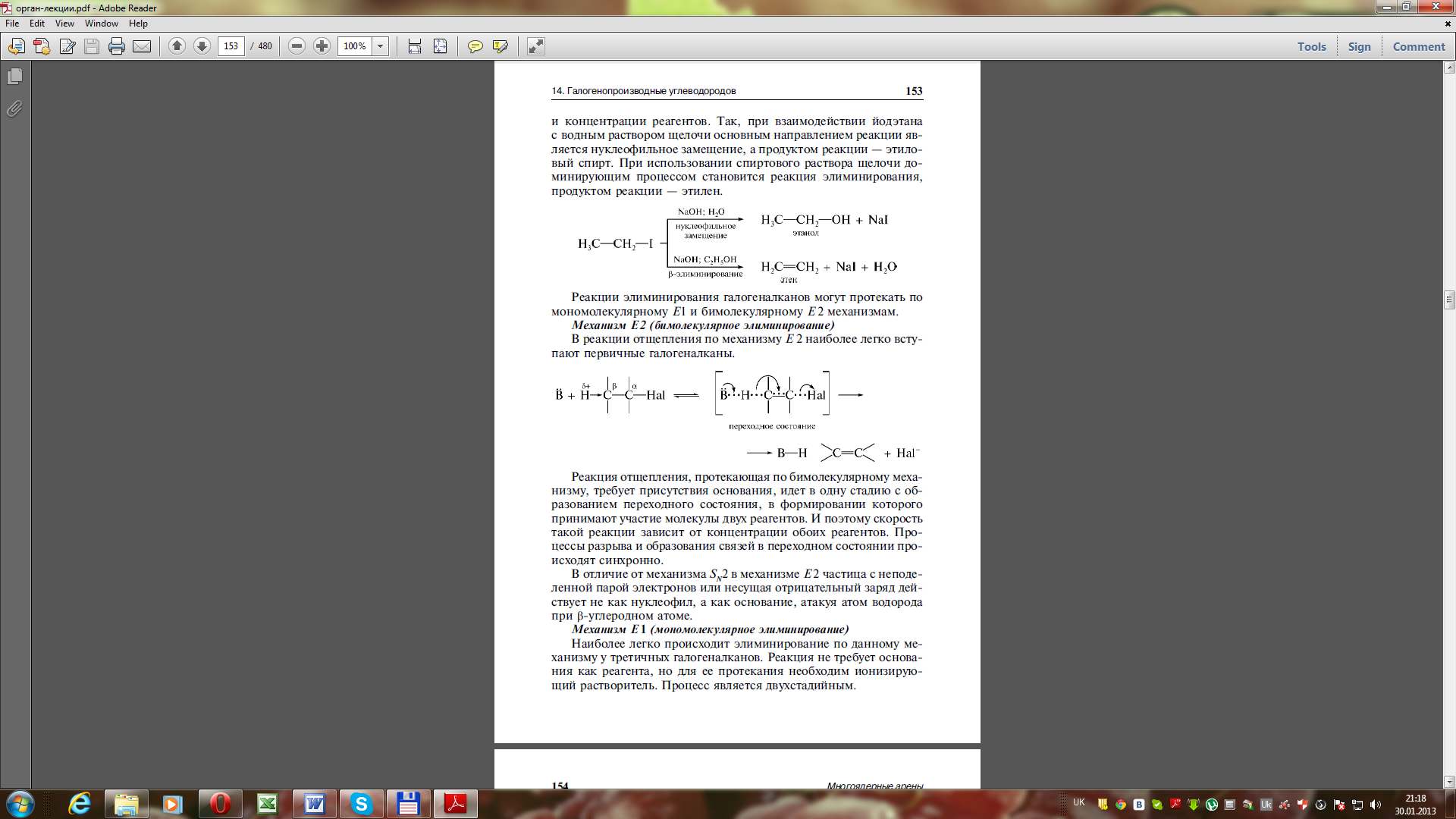
Реакції елімінування (Е) і нуклеофільного заміщення SN конкурують один з одним, але в певних умовах кожна з них може стати домінуючою. Відщеплення галогенводню від галогеналкану стає основним процесом в присутності нуклеофільних реагентів, що мають високу основність (спиртові розчини лугів, алкоголяти лужних металів). Елімінуванню сприяють також підвищення температури реакційної суміші і концентрації реагентів.
Так, при взаємодії йодетану з водним розчином лугу основним напрямком реакції є нуклеофільне заміщення, а продукт реакції – етанол. При використанні спиртового розчину лугу домінуючим процесом стає реакція елімінування, продукт реакції – етилен:
Ііі. Взаємодія з металами
1) Реакція Вюрца – взаємодія моногалогеналканів з металічним натрієм:
2 СН3Cl + 2 Na C2H6 + 2 NaCl
2) З деякими металами (літій, магній, цинк) утворюють металорганічні сполуки (магнійорганічні сполуки - реактиви Гріньяра):
С2Н5Cl + Mg = С2Н5-Mg-Cl
етилмагнійхлорид
Магнійорганічні сполуки є сильними нуклеофільними реагентами і сильними основами. Їх основність обумовлена полярністю звязку Карбон-магній:

Полігалогеналкани (містять декілька атомів галогенів)
Класифікація:
1) Гемінальні – галогенпохідні,в яких два атоми галогенів знаходяться біля одного атому Карбону:
Н3С—СН—Br 1,1-диброметан (гемінальний диброметан)
|
Br
2) Віцинальні – атоми галогенів знаходяться біля суміжних атомів Карбону
Н2С—СН2 1,2-диброметан (віцинальний диброметан)
| |
Br Br
Для галогенпохідних, у яких всі атоми Гідрогену у молекулі заміщені на галоген, у назвах використовують префікс пер- :
Br3С—СBr3 перброметан
Деякі галогеналкани мають тривіальні назви:
CHCl3 (трихлорметан) – хлороформ
CHBr3 (трибромметан) - бромоформ
CHI3 (трийодметан) - йодоформ
F3С—СH–Br (2-бром-1,1,1-трифтор-2-хлоретан) - фторотан
|
Cl
