
- •Лабораторная работа № 10 Коррозия металлов.
- •1. Разделы теоретического курса для повторения.
- •3. Вопросы и упражнения.
- •4. Экспериментальная часть.
- •I. Электрохимическая гетерогенность модели металлических конструкций (опыт проводится под контролем лаборанта).
- •2. Коррозия под каплей электролита
- •3. Защитное действие оксидных пленок на поверхности металла
- •4 . Гальваническая (протекторная) защита
- •К опыту гальваническая (протекторная защита)
- •5. Влияние ингибиторов на процесс коррозии.
- •Стандартные электродные потенциалы некоторых металлов.
Лабораторная работа № 10 Коррозия металлов.
1. Разделы теоретического курса для повторения.
Коррозия металлов. Классификация коррозионных процессов. Химическая и электрохимическая коррозия. Гальванические элементы. Катод и анод гальванического элемента. Катодные и анодные процессы. Причины электрохимической гетерогенности поверхности металла. Коррозия с кислородной и водородной деполяризацией. Пассивность. Защита металлов от коррозии. Легирование, защитные покрытия, изменение свойств коррозионной среды, ингибиторы коррозии. Современные конструкционные материалы. Электрохимическая защита. Катодная и гальваническая (протекторная) защита.
3. Вопросы и упражнения.
1. Какие факторы могут вызвать электрохимическую гетерогенность?
2. Напишите схемы анодного и катодного процессов, имеющих место при электрохимической коррозии стали
а) в водном растворе хлорида натрия?
б) в растворе кислоты.
3. При электрохимической защите от коррозии применяются:
1) контакт с более активным металлом
2) контакт с менее активным металлом
3) источник постоянного тока.
Какие названия носят электрохимические методы защиты.
4. Экспериментальная часть.
I. Электрохимическая гетерогенность модели металлических конструкций (опыт проводится под контролем лаборанта).
Соберите установку для изучения электрохимической гетерогенности модели металлических конструкций (рис.1). Для этого стальную пластинку с медной и алюминиевой заклепками подключите к соответствующим клеммам потенциометра. Погрузите электроды в ячейку с 3% раствором хлорида натрия.
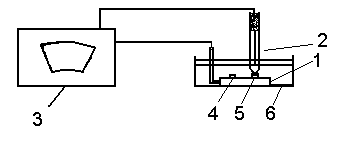
Рис. 1. Схема установки для изучения электрохимической гетерогенности модели металлических конструкций:
I - модель металлической конструкции (стальная пластина с медной и алюминиевой заклепками); 2 - хлорсеребряный электрод сравнения; 3 - потенциометр; 4 - медная заклепка; 5 - алюминиевая заклепка; 6 - ячейка с раствором электролита.
Прикасаясь кончиком электрода сравнения к соответствующим участкам рабочего электрода, определите величину нестационарного неравновесного электродного потенциала на поверхности стали, меди и алюминия по насыщенному хлорсеребряному электроду.
Е (стали) по нас. хлорсер. =
Е (меди) по нас. хлорсер. =
Е (алюминия) по нас. хлорсер. =
На основании полученных значений величин электродных потенциалов, определите анодные и катодные участки металлической конструкции.
Сделайте вывод о окислительно-восстановительных процессах, протекающих на данных металлах при контакте друг с другом.
Напишите уравнения процессов, протекающих на аноде и на катоде данного гальванического элемента, учитывая, что в нейтральной среде электрохимическая коррозия протекает с кислородной деполяризацией.
Чем объясняются близкие значения электродных потенциалов катода и анода в работающем гальваническом элементе?
2. Коррозия под каплей электролита
На хорошо зачищенную стальную пластинку нанести крупную каплю заранее приготовленного раствора, представляющего собой смесь 3%-го раствора хлорида натрия, раствора гексацианоферрата (III) калия K3[Fe(CN)6] (красная кровяная соль) и раствора фенолфталеина.
Через 5-10 минут наблюдать появление синей окраски в центре капли и розовой окраски по периферии капли.
Принимая во внимание, что при взаимодействии ионов железа Fe2+ с ионами [Fe(CN)6]3- образуется имеющий синюю окраску гексацианоферррат(III) железа(II) - Fe3[Fe(CN)6] (турнбулева синь):
Fe2+ + [Fe(CN)6]3- → Fe3[Fe(CN)6],
темно-синяя окраска
объясните, что представляет из себя процесс, протекающий в центре капли.
Розовая окраска фенолфталеина по краям капли указывает на повышенную концентрацию в растворе ионов OH-. Учитывая, что коррозионная среда имеет нейтральную реакцию, сделайте вывод о катодном процессе, протекающем по краям капли?
Чем обусловлена электрохимическая гетерогенность поверхности металла в данном случае?
Нарисуйте схему процесса коррозии металла под каплей электролита, вызванной неравномерной аэрацией. Напишите уравнения анодной реакции (в центре капли) и катодной реакции (по краям капли).
