
- •Лабораторная работа № 8. Окислительно-восстановительные реакции.
- •I. Разделы теоретического курса для повторения.
- •2. Вопросы и упражнения.
- •3. Экспериментальная часть.
- •1. Реакции с участием характерных окислителей.
- •Цвет раствора галогена в бензоле
- •2. Реакции с участием характерных восстановителей.
- •3. Окислительно - восстановительная двойственность.
- •4. Влияние характера среды на протекание окислительно-
- •Цвет некоторых ионов в водном растворе.
- •5. Реакции внутримолекулярного окисления-восстановления на примере термического разложения бихромата аммония.
- •Стандартные окислительно - восстановительные потенциалы.
- •Стандартные электродные потенциалы некоторых металлов.
Цвет некоторых ионов в водном растворе.
Цвет катионов |
Цвет анионов
|
||
Cu2+ |
голубой |
CrO42- |
желтый |
Cr3+ |
зеленый |
Cr2O72- |
оранжевый |
Mn2+ |
бесцветный |
MnO4- |
фиолетовый |
|
|
MnO42- |
зеленый |
5. Реакции внутримолекулярного окисления-восстановления на примере термического разложения бихромата аммония.
(Демонстрационный опыт).
Поместите небольшое количество кристаллического бихромата аммония в виде горки на керамическую плитку или металлическую асбестированную сетку. Нагрейте в пламени горелки стеклянную палочку и внести ее в середину подготовленной горки. Палочку подержите несколько секунд до начала реакции. Запишите наблюдаемые явления.
Составьте уравнения электронного баланса, укажите окислитель и восстановитель и подберите коэффициенты к уравнению реакции, протекающей по схеме:
(NH4)2Cr2O7
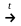 N2
+ Cr2O3
+ H2O
N2
+ Cr2O3
+ H2O
К какому типу окислительно-восстановительных реакций относится данная реакция?
Таблица 3
Стандартные окислительно - восстановительные потенциалы.
Электрод |
Электродная реакция |
E0, B |
S/ S-2 (Pt) |
S+2 |
-0,48 |
Sn+4/ Sn+2 (Pt) |
Sn+4+ |
+0,15 |
Cu+2/ Cu+1 (Pt) |
Cu+2+ |
+0,153 |
O2/ OH- (Pt) |
|
+0,401 |
I2/ I- (Pt) |
I2 + 2e → 2I- |
+0,536 |
Fe+3/ Fe+2 (Pt) |
Fe+3 + 1e → Fe+2 |
+0,771 |
Br2/ Br- (Pt) |
Br2 + 2e → 2Br- |
+1,065 |
Cl2/ Cl- (Pt) |
Cl2 + 2e → 2Cl- |
+1,360 |
H+, MnO4-/Mn+2 |
MnO4- +8H+ + 5e → Mn+2 + 4H2O |
+1,518 |
PbO2,H+,SO42-/PbSO4 (Pt) |
PbO2 +4H+ +SO42- +2e → PbSO4 +2 H2O |
+1,685 |
F2/ F- (Pt) |
F2 + 2e → 2F- |
+2,87 |
Таблица 4
Стандартные электродные потенциалы некоторых металлов.
Электрод
|
Е0298, В |
Электрод |
Е0298, В |
Электрод |
Е0298, В |
|
Li+/Li |
-3,04 |
Zn2+/Zn |
-0,76 |
Sb3+/Sb |
0,20 |
|
K+/K |
-2,92 |
Cr3+/Cr |
-0,74 |
Bi3+/Bi |
0,23 |
|
Ba2+/Ba |
-2,90 |
Fe2+/ Fe |
-0,44 |
Cu2+/Cu |
0,34 |
|
Ca2+/Ca |
-2,87 |
Cd2+/Cd |
-0,40 |
Co3+/Co |
0,40 |
|
Na+/Na |
-2,71 |
Co2+/Co |
-0,28 |
Сu1+/ Cu |
0,52 |
|
La3+/La |
-2,37 |
Ni2+/Ni |
-0,25 |
Hg22+/Hg |
0,79 |
|
Mg2+/Mg2+ |
-2,36 |
Mo3+/Mo |
-0,20 |
Ag+/Ag |
0,80 |
|
Ti2+/Ti |
-1,75 |
Sn2+/Sn |
-0,14 |
Hg2+/Hg |
0,85 |
|
Al3+/Al |
-1,66 |
Pb2+/Pb |
-0,13 |
Pd2+/Pd |
0,98 |
|
Mn2+/Mn2+ |
-1,05 |
Fe3+/Fe |
-0,04 |
Pt/Pt2+ |
1,19 |
|
Nb3+/Nb |
-1,1 |
2H+ / H2 |
0,00 |
Au3+/Au |
1,50 |
|

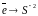


 O2
+ 2H2O + 4e → 4OH-
O2
+ 2H2O + 4e → 4OH-