
- •2 Вопрос
- •3 Вопрос
- •4 Вопрос
- •1 Вопрос
- •3 Вопрос производство оксидов урана
- •8.1 Получение оксидов урана из раствора уранилнитрата
- •8.2 Получение оксидов из диураната аммония
- •8.3 Производство оксидов урана из пероксида урана
- •8.4 Производство оксидов урана из оксалата уранила
- •4 Вопрос
- •2.4 Карбонатное выщелачивание урановых руд
1 Вопрос










3 Вопрос производство оксидов урана
Оксиды урана имеют весьма важное значение в технологии производства ядерного горючего.
8.1 Получение оксидов урана из раствора уранилнитрата
На рис. 8.1 представлена технологическая схема производства триоксида урана из раствора уранилнитрата.
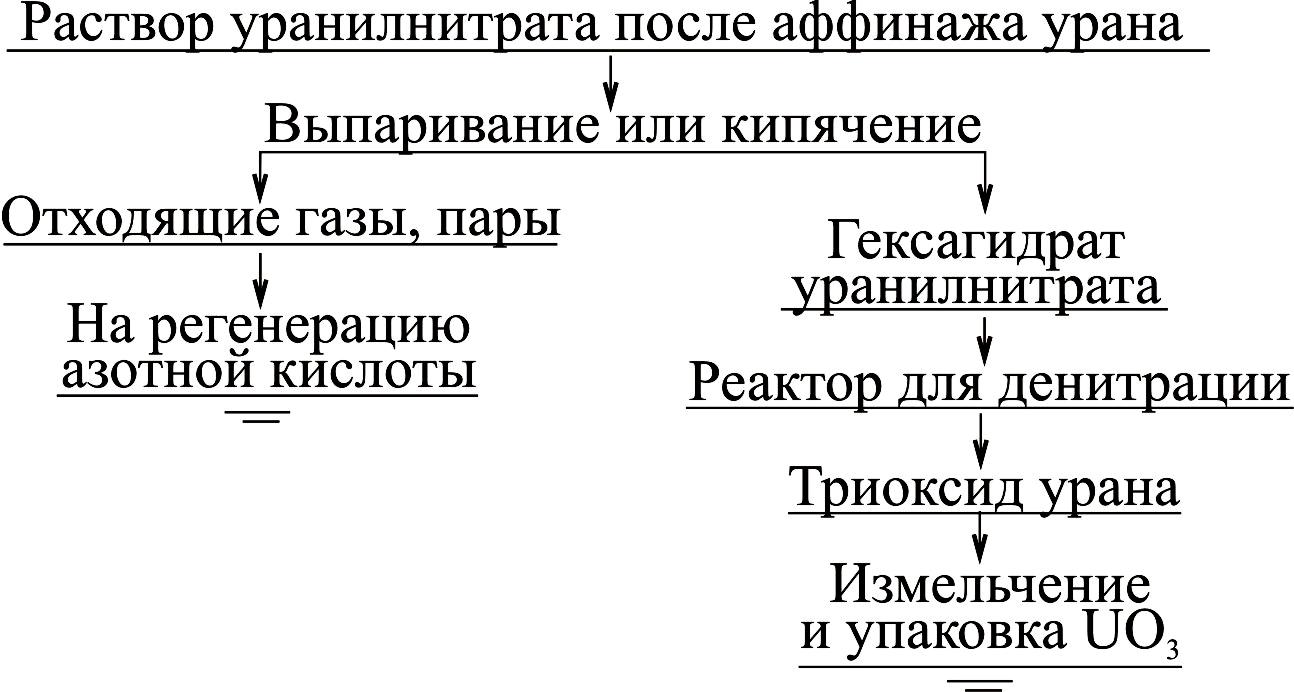
Рисунок 8.1 – Технологическая схема производства триоксида урана из раствора уранилнитрата.
Очищенный раствор уранилнитрата после аффинажа урана выпаривают до концентрации, соответствующей составу UO2(NO3)2·6H2O гексагидрата уранилнитрата. Дальнейшее прокаливание гексагидрата уранилнитрата происходит в реакторе для денитрации, где протекает дополнительная дегидратация и денитрация продукта с образованием триоксида урана по реакции
UO2(NO3)2·6H2O → UO3 + NO + NO2 + O2 + 6H2O (8.1)
Первое превращение шестиводного гидрата уранила при термическом разложении идет до тригидрата по реакции
UO2(NO3)2·6H2O → UO2(NO3)2·3H2O + 3H2O
Окончательное разложение протекает по следующим реакциям:
UO2(NO3)2·2H2O → UO2(NO3)2 + 2H2O (8.6)
UO2(NO3)2 → UO3 + N2O4 + ½O2
Денитрация в вакууме протекает быстрее, чем при атмосферном давлении. Скорость нагрева также влияет на кинетику разложения. При меньших скоростях нагрева уранилнитрат разлагается при более низкой температуре. Несмотря на различие процессов разложения при низких температурах на воздухе и в вакууме, температура диссоциации UO2(NO3)2 во всех случаях почти одинакова. Оптимальной температурой разложения уранилнитрата до триоксида урана считается 400 оС, так как выше 430 оС триоксид урана начинает отщеплять кислород. Кроме того, при низкой температуре получается более реакционноспособный триоксид урана, легко превращаемый в диоксид урана и тетрафторид урана, что очень важно. Поэтому за оптимальную температуру термической диссоциации уранилнитрата принимают 400-450 оС.
8.2 Получение оксидов из диураната аммония
При действии на соли уранила аммиака выделяется осадок переменного состава, которому обычно приписывают состав диураната аммония. При обычном режиме осаждения состав получаемого осадка выражается формулой (NH4)2U4O13. Это самый распространенный в технологии урана промежуточный продукт. Ценность его для получения оксидов урана заключается в том, что он не содержит в своем составе нелетучих компонентов, кроме урана, а образующийся при прокаливании аммиак повторно используется в производстве.
Диуранат аммония может быть переведен либо в триоксид урана, либо в закись-окись U3O8 в зависимости от температуры прокаливания. В первом случае при температуре 250-400 оС на воздухе процесс протекает по уравнению
(NH4)2U2O7 → 2UO3 + 2NH3 + H2O (8.8)
При более высоких температурах 600-900 оС термическая диссоциация диураната аммония сопряжена с образованием закиси-окиси урана по реакции
9(NH4)2U2O7 → 6U3O8 + 14NH3 + 15H2O + 2N2 (8.9)
Влажный диуранат аммония подвергается прокаливанию. Удаление воды и аммиака зависит от температуры. При температуре 400 оС аммиак удаляется практически полностью, вода – в большей части.
При температуре 600 оС вода и аммиак удаляются полностью, однако в этих условиях уже протекает разложение триоксида урана на закись-окись урана и кислород.
Углекислота удаляется из раствора, а аммиак обусловливает равномерное повышение значение рН-среды и осаждение ураната аммония.
Повышение температуры прокаливания диураната аммония связано с постепенным увеличением насыпного веса и среднего размера кристаллов оксидов урана. При высокой скорости прокаливания влажного диураната аммония всегда получается более плотный продукт, чем при малой скорости прокаливания.
Таким образом, при прокаливании диураната аммония получаются сравнительно пористые оксиды урана с малым размером частиц и малым насыпным весом. Наиболее целесообразно использовать эти продукты для производства керамических тепловыделяющих элементов.
Аммиак, выделяющийся при термической диссоциации диураната аммония, при высоких температурах распадается практически количественно на азот и водород. Образующийся водород может восстановить триоксид урана до диоксида по реакциям:
(NH4)2U2O7
![]() 2UO3
+ 2NH3
+ H2O; (8.15)
2UO3
+ 2NH3
+ H2O; (8.15)
2UO3
![]()
![]() U3O8
+
U3O8
+
![]() O2; (8.16)
O2; (8.16)
2NH3 → N2 + 3H2; (8.17)
U3O8
+
![]() H2
→ 2UO2
+
H2O; (8.18)
H2
→ 2UO2
+
H2O; (8.18)
________________________________________________________
(NH4)2U2O7
→ 2UO2
+ N2
+
![]() H2
+
O2
+
H2
+
O2
+
![]() H2O (8.19)
H2O (8.19)
При температурах ниже 450 оС восстановление урана практически не происходит, что связано с незначительной термической диссоциацией аммиака в этих условиях. При более высоких температурах аммиак диссоциирует в большей степени и процесс восстановления интенсифицируется.
С увеличением температуры прокаливания диураната аммония увеличивается насыпной вес оксидов урана; при температуре выше 800 оС наблюдается частичное оплавление продукта.
