
- •3.1)Реакция с хлоридом алюминия.
- •31). Цианидиновая реакция.
- •2). Борно-лимонная реакция (р. Вильсона)
- •3.) Реакция с хлоридом алюминия.
- •6).Реакция на катехины с ванилином.
- •Скумпия кожевенная - Cotinus coggygria, сумаховые – Anacardiaceae лист скумпии - folia cotini coggygriae
- •2). Борно-лимонная реакция (р. Вильсона)
- •3.) Реакция с хлоридом алюминия.
- •6).Реакция на катехины с ванилином.
- •5.& Горец птичий - Polygonum aviculare – Polygonaceae herba polygoni avicularis
2). Борно-лимонная реакция (р. Вильсона)
3.) Реакция с хлоридом алюминия.
4). Реакция с раствором щелочи.Флавоноиды дают желтое окрашивание, при нагревании переходящее в красное, халконы и ауроны дают сразу красное окрашивание, антоцианы -синее.
5.) Флавоноиды, содержащие свободные орто-гидроксильные группы вкольце В, при обработке ацетатом свинца дают осадки ярко-желтой окраски,Антоцианы образуют осадки окрашенные в красный или синий цвет(взависимости от рН среды).
6).Реакция на катехины с ванилином.
2 ДВ в растительном сырье определяют качественными реакциями, которые можно подразделить на 2 группы: реакции осаждения и цветные реакции. Реакции осаждения проводят с 1% раствором желатина, с 1% раствором хлорида хинина или другого алкалоида, раствором ацетата свинца основного. При наличии дубильных веществ появляется осадок или муть. Классической цветной реакцией на дубильные вещества является реакция с 1% раствором железоаммонийных квасцов. С этим реактивом гидролизуемые дубильные вещества дают черно-синее окрашивание, конденсированные – черно-зеленое.
реакции позволяющие определить их совместное присутствие.1).Реакция Стиасни с 40% раствором формальдегида и конц НСl. Конденсированные дубильные вещества выпадают в осадок. Осадок отфильтровывают. В фильтрате определяют гидролизуемые дубильные вещества по реакции с железоаммонийными квасцами в присутствии кристаллического ацетата свинца или ацетата натрия. Появляется синее или фиолетовое окрашивание.2) Реакция со средней солью ацетата свинца в присутствии 10% раствора уксусной кислоты. Осаждаются гидролизуемые дубильные вещества(черно-зеленое). 3) Реакция с бромной водой.Конденсированные дубильные вещества выпадают в осадок сразу
4. В настоящее время главный методом определения флавоноидов в сырье является СФ по р. хлоридом алюминия определяют сумму флавоноидов в траве зверобоя, горца птичьего. СФ по собственному поглощению определяют сумму флавоноидов. Некоторые виды сырья стандартизуются по содержанию основного флавоноида. для количественного опр дубильных в-в широко используют перманганометрический метод Левенталя (ГФ 11)метод основан на том что водное извлечение таннидов определяют путем их окисления перманганатом калия в сильноразбавленных растворах в присутствии индигосульфокислоты до золотисто-желтого окрашивания. Титрование ведут медленно, при сильном разбавлении раствора. Окисление дубильных веществ идет по о-гидроксильным группам.
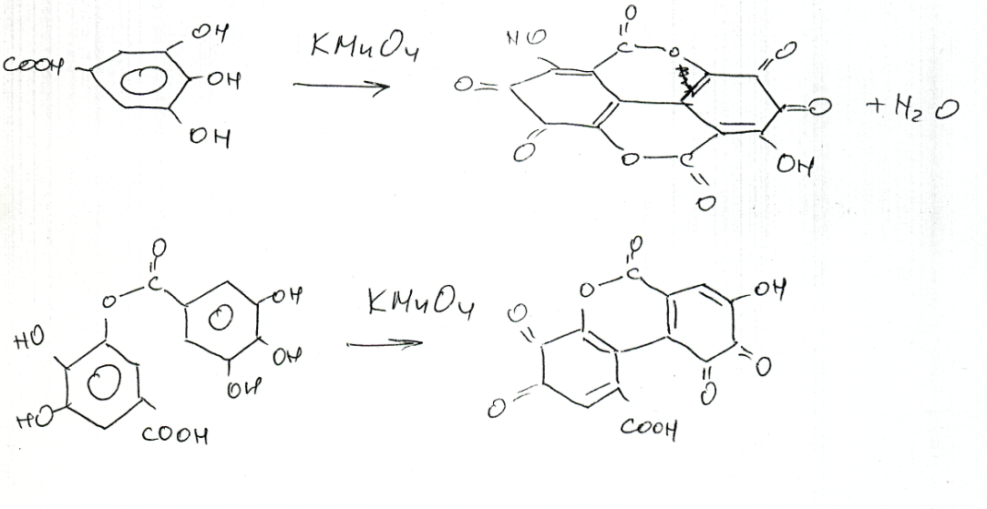
Метод однако неточен и дает завышенные результаты, поскольку окисляются и другие соединения (простые полифенолы).
5.& Горец птичий - Polygonum aviculare – Polygonaceae herba polygoni avicularis
Черемуха обыкновенная - Padus avium, Ч азиатская - Padus asiatica - Rosaceae ПЛОДЫ ЧЕРЕМУХИ - FRUCTUS PADI
Черника обыкновенная - Vaccinium myrtillus - Ericaceae
7.черемуха-высокий кустарник или дерево высотой 2-10 м. кора матовая, черно-серая. Листья очередные, эллиптические, короткочерешковые, край листа с зубцами. цветки ароматные, в густых кистях, лепестки с коротким ноготком, белые. плоды- шаровидные, черные, сочные, вяжущие костянки. 2 растет по берегам рек, приречных лесах, среди зарослей.3)в период созревания плодов; 4)собирают неповрежденные зрелые плоды, очищают от примесей листочков. сушат в сушилках 40-50; 5)плоды-костянки шарообр формы, d-8мм, морщинистые, черные матовые. запах слабый,
горец
|
Дик в РФ и РТ |
по Сум флаваноидов в пересчета на авикумарин |
Настой (мочегонный, противовосп |
черемуха
|
Дик РТ Дик РФ |
По сод дубильных веществ |
Отвар – вяжущее средство |
черника
|
Дик РТ
|
Не стандарт |
Отвар-вяжущее |
Билет 10
2. флавоноиды - твердые кристаллические вещества с определенной температурой плавления, окрашенные в желтый цвет или бесцветные или окрашены в красный или синий цвет в зависимости от рН среды. Гликозиды флавоноидов растворимы в воде и водно-спиртовых растворах и нерастворимы в органических растворителях (эфире, хлороформе). Агликоны, напротив, растворимы в эфире, хлороформе, спирте и плохо в воде. агликоны катехинов, лейкоантоцианидинов, флаванонов и флаванонолов обладают оптической активностью.
Дубильные вещества – аморфные вещества желтого или бурого цвета, растворимые в воде, этаноле, ацетоне, пиридине, бутаноле и этилацетате и нерастворимые в эфире, хлороформе, бензоле. Многие дубильные вещества оптически активны, легко окисляются на воздухе, образуя темно-окрашенные продукты.
33.на флавоноиды:
1). Цианидиновая реакция.
2). Борно-лимонная реакция (р. Вильсона)
Используется как качественная в ФС на рутин, на этой реакции основан фармакопейный метод количественного определения рутина.
3). Реакция с хлоридом алюминия.
4). Реакция с раствором щелочи.
Флавоноиды дают желтое окрашивание, при нагревании переходящее в красное, халконы и ауроны дают сразу красное окрашивание, антоцианы -синее.
5). Флавоноиды, содержащие свободные орто-гидроксильные группы в кольце В, при обработке ацетатом свинца дают осадки ярко-желтой окраски, Антоцианы образуют осадки окрашенные в красный или синий цвет .
6).Реакция на катехины с ванилином.
7). Иногда в качественном анализе используются общефенольиые и неспецифические для флавоноидов реакции с солями трехвалентного железа (настойка софоры японской) или азосочетания.На дубильные вещества: Дубильные вещества в растительном сырье определяют качественными реакциями, которые можно подразделить на 2 группы: реакции осаждения и цветные реакции. Реакции осаждения являются общими, их используют для обнаружения дубильных веществ, цветные реакции позволяют установить пренадлежность дубильных веществ к определенной группе. Реакции осаждения проводят с 1% раствором желатина, с 1% раствором хлорида хинина или другого алкалоида, раствором ацетата свинца основного. При наличии дубильных веществ появляется осадок или муть. Классической цветной реакцией на дубильные вещества является реакция с 1% раствором железоаммонийных квасцов. С этим реактивом гидролизуемые дубильные вещества дают черно-синее окрашивание, конденсированные – черно-зеленое. Зачастую в сырье одновременно присутствуют обе группы дубильных веществ и существуют реакции позволяющие определить их совместное присутствие.
1)Реакция Стиасни с 40% раствором формальдегида и концентрированной НСl. Реакция идёт 30 минут при нагревании в колбе, снабженной обратным холодильником. Конденсированные дубильные вещества выпадают в осадок. Осадок отфильтровывают. В фильтрате определяют гидролизуемые дубильные вещества по реакции с железоаммонийными квасцами в присутствии кристаллического ацетата свинца или ацетата натрия. Появляется синее или фиолетовое окрашивание.2)Реакция со средней солью ацетата свинца в присутствии 10% раствора уксусной кислоты. Осаждаются гидролизуемые дубильные вещества. В фильтрате определяют конденсированные дубильные вещества по реакции с железоаммонийными квасцами (черно-зеленое).3)Реакция с бромной водой.Конденсированные дубильные вещества выпадают в осадок сразу. Если в сырье присутствуют гидролизуемые дубильные вещества, они выпадают в осадок лишь при избытке брома и постепенно.
4. В настоящее время главным методом определения флавоноидов в сырье является спектрофотометрия. Причем если ранее использовались как варианты СФ по собственному поглощению флавоноидов в области ближнего УФ (350-390 нм), так и по поглощению производных с хлоридом алюминия (410-450 нм), что заметно при анализе частных статей ГФ XI, то в настоящее время в основном используют второй вариант.
СФ по собственному поглощению определяют сумму флавоноидов в корнях стальника, цветках пижмы, цветках бессмертника, плодах боярышника, траве сушеницы топяной, траве овса посевного, траве эрвы шерстистой. При этих определениях требуется дополнительная очистка получаемых экстрактов и часто эти методики совмещаются с различными вариантами хроматографии (плоды боярышника и трава сушеницы топяной - на колонках с полиамидом).
Для определения дубильных веществ в ЛРС принята перманганатометрическая методика Левенталя, основанная на окислении фенольных гидроксилов KMnO4 в кислой среде в присутствии индикатора – индигокармина.
Титрование ведут медленно, при сильном разбавлении раствора. Окисление дубильных веществ идет по о-гидроксильным группам.
Метод однако неточен и дает завышенные результаты, поскольку окисляются и другие соединения (простые полифенолы).
Для определения танинов в ЛРС применяют также метод комплексонометрического титрования трилоном Б с индикатором ксиленоловым оранжевым после осаждения дубильных веществ сульфатом цинка (листья скумпии и сумаха) и спектрофотометрии (сумма танинов в пересчете на казуаринин не менее 15% в листьях облепихи крушиновидной – ТУ 64-4117-94).
1) От примесей углеводов в водном растворе предложено избавляться добавляя к растворам 4-х кратные количества ацетона или этанола. Углеводы выпадают в осадок, танины остаются в растворе.2) . С этим реактивом гидролизуемые дубильные вещества дают черно-синее окрашивание, конденсированные – черно-зеленое.3) . Осаждаются гидролизуемые дубильные вещества.4) Реак нейтрализации с натрием гидрокарб.
5.
Горец перечный - Polygonumhydropiper – Polygonaceae HERBA POLYGONI HYDROPIPERIS |
Дик РТ |
по Сум флаваноидов в пересчета на кверцитин |
Настой, жидкий экстракт (кровоостанавливающее) |
Корневище змеевика-Rhizoma Bistortae.Гречишные-Polygonaceae
|
Дик в рф |
По сумм дубильных в-в |
Отвар-при острых хронических поносах,сборы |
Софора японская - Sophora japonica – Fabaceae ,БУТОНЫ СОФОРЫ ЯПОНСКОЙ - ALABASTRA SOPHORAE JAPONICAE
|
культ |
Бутоны по рутину плоды НЕ стд |
Бутоны -Рутин, кверцитин (антиоксиданты, уменьшают проницаемость капиляров) плоды - настойка (противомикр) |
7.1)У водяного перца стебли восходящие, выс до 70 см. листья очередные с раструбами.а) водяной перец – цв мелкие, собранные в редкие, тонкие,обычно прерывистые, поникающие колосовидные соцветия.Околоцветник зеленый, раструбы цилиндрические, красноватые по краю с короткими щетинками.Листья короткочерешковые, продолговато-ланцетные, заостренные, цельнокрайние голые. 2)Растут как сорняки.Они предпочитают влажные места обитания:берега рек и водоемов,заболоченныеместа,сырые луга.3)Собирают во время цветения.4)Траву срезают дл до 50 см и сразу же очищают от дррастений,пожелтевших и пораженных вредителями и болезнями частей растения,земли,после чего сушат в хор проветриваемом помещении.5)Цельное и измельченное сырье.6)по общ списку
Билет 11
2флавоноиды - твердые кристаллические вещества с определенной температурой плавления, окрашенные в желтый цвет или бесцветные или окрашены в красный или синий цвет в зависимости от рН среды. Гликозиды флавоноидов растворимы в воде и водно-спиртовых растворах и нерастворимы в органических растворителях (эфире, хлороформе). Агликоны, напротив, растворимы в эфире, хлороформе, спирте и плохо в воде. агликоны катехинов, лейкоантоцианидинов, флаванонов и флаванонолов обладают оптической активностью.
Дубильные вещества – аморфные вещества желтого или бурого цвета, растворимые в воде, этаноле, ацетоне, пиридине, бутаноле и этилацетате и нерастворимые в эфире, хлороформе, бензоле. Многие дубильные вещества оптически активны, легко окисляются на воздухе, образуя темно-окрашенные продукты
3.
4..В настоящее время главным методом определения флавоноидов в сырье является спектрофотометрия. Причем если ранее использовались как варианты СФ по собственному поглощению флавоноидов в области ближнего УФ (350-390 нм), так и по поглощению производных с хлоридом алюминия (410-450 нм), что заметно при анализе частных статей ГФ XI, то в настоящее время в основном используют второй вариант.
СФ по собственному поглощению определяют сумму флавоноидов в корнях стальника, цветках пижмы, цветках бессмертника, плодах боярышника, траве сушеницы топяной, траве овса посевного, траве эрвы шерстистой. При этих определениях требуется дополнительная очистка получаемых экстрактов и часто эти методики совмещаются с различными вариантами хроматографии (плоды боярышника и трава сушеницы топяной - на колонках с полиамидом).
Для определения дубильных веществ в ЛРС принята перманганатометрическая методика Левенталя, основанная на окислении фенольных гидроксилов KMnO4 в кислой среде в присутствии индикатора – индигокармина.
Титрование ведут медленно, при сильном разбавлении раствора. Окисление дубильных веществ идет по о-гидроксильным группам.
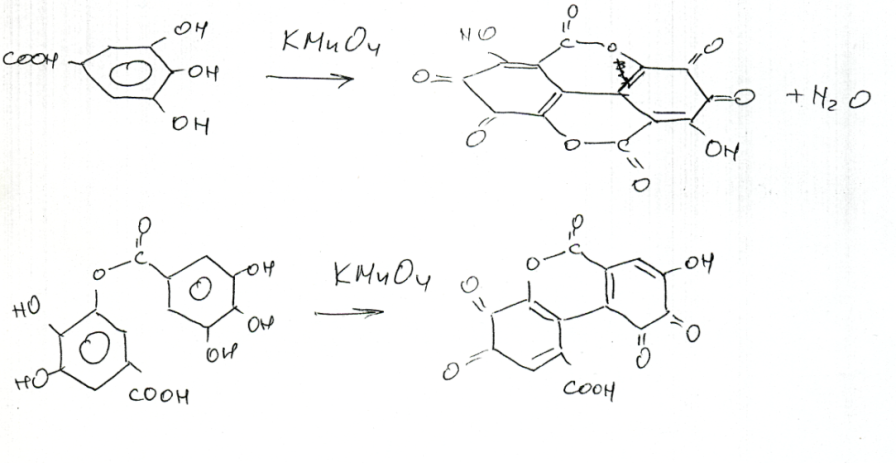
Метод однако неточен и дает завышенные результаты, поскольку окисляются и другие соединения (простые полифенолы).Для определения танинов в ЛРС применяют также метод комплексонометрического титрования трилоном Б с индикатором ксиленоловым оранжевым после осаждения дубильных веществ сульфатом цинка (листья скумпии и сумаха) и спектрофотометрии (сумма танинов в пересчете на казуаринин не менее 15% в листьях облепихи крушиновидной – ТУ 64-4117-94).
От примесей углеводов в водном растворе предложено избавляться добавляя к растворам 4-х кратные количества ацетона или этанола. Углеводы выпадают в осадок, танины остаются в растворе.2) . С этим реактивом гидролизуемые дубильные вещества дают черно-синее окрашивание, конденсированные – черно-зеленое.3) . Осаждаются гидролизуемые дубильные вещества.4) Реак нейтрализации с натрием гидрокарб
|
Дик РТ |
По Сум флаваноидов и фенолкарбоновых кислот в пересчете на лютеин |
Настой желчегонный противовосп «Танацехол» желчегонный, спазмолитический |
|
Дик РФ |
По сод дубильных веществ |
Отвар – вяжущее средство |
|
Дик РТ |
Не стд |
Настой (мочегонный), сух. Экстакт, в составе «Марилин» спазмолит |
Хвощ:1) Многолетнее травянистое споровое растение,высотой до 60 см, с длинным (до 5—7 м) ползучим, буровато-черным корневищем, с черными шаровидными клубеньками, Ветви располагаются мутовками по 8—16 по всему стеблю. Стебли и ветви жесткие, шершавые на ощупь из-за образующихся в них кристаллов кремниевой кислоты. Листья недоразвитые, срастаются на стебле в цилиндрические трубчатые влагалища.2) Растет на рыхлых супесчаных и суглинистых свежих почвах на полях, в посевах, на железнодорожных насыпях, лесных полянах, на песчаных берегах рек 3-4) Заготавливают всю надземную часть (Herba Equiseti) летом, в июне — августе, срезая серпами, ножами или скашивая косами на высоте 5 см от поверхности почвы. Сушат на чердаках, под навесами, раскладывая слоем толщиной 5—7 см, или в сушилках при температуре 40—50°C. В сухую погоду сырье можно сушить в тени строений.5)трава серовато-зеленого цвета 6) Срок годности сырья 4 года, Хранят в сухом месте.
Билет 12
дубильные вещества подразделяют на:
а) гидролизуемые дубильные вещества, распадающиеся в условиях кислотного или энзиматического гидролиза на простейшие составные части; включают галлотаннины, эллаготаннины и несахаридные эфиры карбоновых кислот;
б) конденсированные дубильные вещества, не распадающиеся под действием кислот, а образующие продукты конденсации — флобафены; подразделяют на производные флаван-3-олов, флаван-3,4-диолов, оксистильбенов.
Галлотаннины — сложные эфиры сахара и галловой кислоты. Встречаются моно-, ди-, три-, тетра-, пента- и полигаллоильные эфиры. Моногаллоильный эфир β-D-глюкогаллин выделен из корня китайского ревеня. Важнейшие источники галотаннинов, применяемых в медицине, — галлы турецкие и китайские, а также листья скумпии кожевенной и сумаха дубильного.
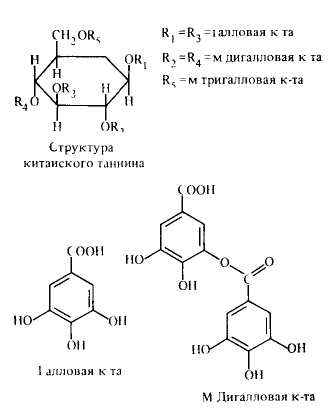
Китайский танин, выделенный из галлов китайских, представляет гетерогенную смесь веществ различного строения и является окта- и нонагаллоилглюкозой; турецкий танин, выделенный из галлов турецких, представляет собой гекса- и пентагаллоилглюкозу.
Эллаготаннины — сложные эфиры сахара и гексаоксидифеновой, хебуловой, бревифолинкарбоновой и др. кислот, имеющих биогенетическое родство с эллаговой кислотой. Они сложнее по структуре и содержатся в тропических растениях. дубильные вещества подразделяют на:
а) гидролизуемые дубильные вещества, распадающиеся в условиях кислотного или энзиматического гидролиза на простейшие составные части; включают галлотаннины, эллаготаннины и несахаридные эфиры карбоновых кислот;
б) конденсированные дубильные вещества, не распадающиеся под действием кислот, а образующие продукты конденсации — флобафены; подразделяют на производные флаван-3-олов, флаван-3,4-диолов, оксистильбенов.
Галлотаннины — сложные эфиры сахара и галловой кислоты. Встречаются моно-, ди-, три-, тетра-, пента- и полигаллоильные эфиры. Моногаллоильный эфир β-D-глюкогаллин выделен из корня китайского ревеня. Важнейшие источники галотаннинов, применяемых в медицине, — галлы турецкие и китайские, а также листья скумпии кожевенной и сумаха дубильного.
К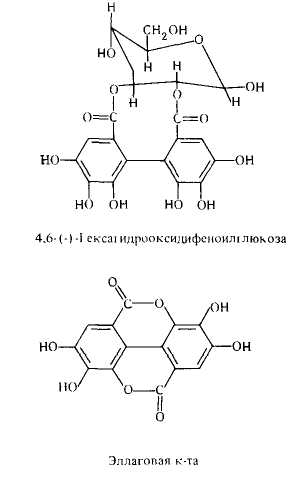 итайский
танин, выделенный из галлов китайских,
представляет гетерогенную смесь веществ
различного строения и является окта- и
нонагаллоилглюкозой; турецкий танин,
выделенный из галлов турецких, представляет
собой гекса- и пентагаллоилглюкозу.
итайский
танин, выделенный из галлов китайских,
представляет гетерогенную смесь веществ
различного строения и является окта- и
нонагаллоилглюкозой; турецкий танин,
выделенный из галлов турецких, представляет
собой гекса- и пентагаллоилглюкозу.
Эллаготаннины — сложные эфиры сахара и гексаоксидифеновой, хебуловой, бревифолинкарбоновой и др. кислот, имеющих биогенетическое родство с эллаговой кислотой. Они сложнее по структуре и содержатся в тропических растениях.
Дубильные вещества – аморфные вещества желтого или бурого цвета, растворимые в воде, этаноле, ацетоне, пиридине, бутаноле и этилацетате и нерастворимые в эфире, хлороформе, бензоле. Многие дубильные вещества оптически активны, легко окисляются на воздухе, образуя темно-окрашенные продукты
3. Для обнаружения дубильных веществ используют следующие реактивы:
Раствор желатина - к 2-3 мл испытуемого раствора добавляют по каплям раствор желатина; появляется муть, исчезающая при добавлении избытка желатина;
Бромная вода - к 2-3 мл испытуемого раствора прибавляют по каплям бромную воду (5 г брома в 1 л воды) до появления в растворе запаха брома; в случае присутствия конденсированных дубильных веществ образуется осадок.
4. Для определения дубильных веществ в ЛРС принята перманганатометрическая методика Левенталя, основанная на окислении фенольных гидроксилов KMnO4 в кислой среде в присутствии индикатора – индигокармина.
Титрование ведут медленно, при сильном разбавлении раствора. Окисление дубильных веществ идет по о-гидроксильным группам.
Метод однако неточен и дает завышенные результаты, поскольку окисляются и другие соединения (простые полифенолы).
Для определения танинов в ЛРС применяют также метод комплексонометрического титрования трилоном Б с индикатором ксиленоловым оранжевым после осаждения дубильных веществ сульфатом цинка (листья скумпии и сумаха) и спектрофотометрии (сумма танинов в пересчете на казуаринин не менее 15% в листьях облепихи крушиновидной – ТУ 64-4117-94).
1) От примесей углеводов в водном растворе предложено избавляться добавляя к растворам 4-х кратные количества ацетона или этанола. Углеводы выпадают в осадок, танины остаются в растворе.2) . С этим реактивом гидролизуемые дубильные вещества дают черно-синее окрашивание, конденсированные – черно-зеленое.3) . Осаждаются гидролизуемые дубильные вещества.4) Реак нейтрализации с натрием гидрокарб.
5.
Сумах дубильный - Rhus coriaria Сем. сумаховые – Anacardiaceae ЛИСТ СУМАХА - FOLIUM RHUS CORIARIAE |
Дик РФ культРФ |
1) По танину 2) Сум флаваноидов |
«Танин» (вяжущее противовосп. Ср-во) |
Ольха серая - Alnus incala Ольха клейкая - Alnus glutinosa Сем. березовые – Betulacea СОПЛОДИЯ ОЛЬХИ (ОЛЬХ. ШИШКИ) - FRUCTUS ALNI |
Дик РТ Дик РФ * |
По сод дубильных веществ Собир. Зрелые плоды, отделяют от примесей, сушат при 50С |
Отвар – вяжущее средство «Ольтан» противомикробное ср-во |
Облепиха крушиновидная - Hippophae rhamnoides– Elaeagnaceae ЛИСТЬЯ ОБЛЕПИХИ - FOLIAS HIPPOPHAES |
Дик РТ |
По сод дубильных веществ (СФМ) |
Облепиховое масло,суппозитории,препараты: «Олазоль», «Гипозоль» и др. |
7.Ольха:1) Дерево высотой до 20 м с серой гладкой корой. Побеги бурые или красно-бурые, покрыты сырым коротким пушком с примесью волосков (1). Почки красно-бурые, тёмные, тупые, слабо опушённые , длиной 8-15 мм, отстоят от побега и немного отогнутые, в отличие от почек ольхи чёрной, неклейкие .Серёжки с тычинковыми и пестичными цветками располагаются на концах побегов прошлого года по несколько штук; Шишечки длиной около 10 мм и шириной 6-8 мм. Листья яйцевидно-эллиптические с тонким опушением. Плод — орешек с узкими перепончатыми краями, созревает осенью.2) в лесной зоне 3)осенью-зимой 4)при этом секатором срезают концы тонких веток,с которых затем обрывают соплодия.собранное сырье складывают в мешки и доставляют к месту сушки.сушат на чердаках или под навесами,сушилках,разложив тонким слоем,перемешивая.5)яйцевидные и продолговатые соплодия ольхи ,темно-бурого цвета 6)хранят в сухом месте
