
- •Ю.С. Щербаков
- •Ю.С. Щербаков, к.Т.Н., доцент кафедры бЖиЭ. – Физико-химические процессы в техносфере Электронное учебное пособие. – Новосибирск:
- •Содержание
- •1.Введение в физические и химические процессы, происходящие в техносфере. Основные понятия и определения
- •4.6 Тяжелые металлы…..………………………………………………………….……117
- •5 . Миграция загрязнителей атмосферы, гидросферы и литосферы. Биотический перенос загрязнителей.
- •5.2 Особенности миграции радионуклидов и прогнозирование радиоактивного загрязнения местности………….………………………………………………………137
- •Введение
- •1. Введение в физические и химические процессы в техносфере. Основные термины. Понятия и определения
- •1.1 Основные термины, понятия и определения
- •Типы классификаций реакции.
- •2. По тепловому эффекту
- •3. По присутствию других веществ
- •2. Закон Бойля-Мариотта - При постоянной температуре объем данного количества газа обратно пропорционально давлению, под которым он находится
- •3. Закон Гей-Люссака - При постоянном давлении изменение объема газа прямо пропорционально температуре
- •4.Закон объемных отношений
- •5.Закон действующих масс
- •Зависимость скорости реакции
- •Зависимость скорости реакции
- •Закон Кюри
- •Закон постоянства состава вещества
- •Закон сохранения массы вещества
- •1.2 Техносфера и ее состав
- •1.3 Учение в.И. Вернадского о биосфере
- •1.4 Ноосфера
- •1.5 Распространенность химических веществ в окружающей среде
- •1.6 Кларки химических элементов в биосфере, атмосфере, гидросфере, литосфере и космосе
- •1.7 Биофильность и технофильность химического элемента. Тупиковый характер потоков технофильных элементов в биосфере
- •1.8 Система параметров, характеризующих границу предельно допустимого уровня загрязнения окружающей среды
- •2. 2. Физика и химия атмосферы и ее загрязнителей
- •2.1 Общие сведения об атмосфере
- •2.2 Температурный режим системы “Земля-атмосфера”. Изменение температурного режима, “парниковый” эффект
- •2.3 Тепловой баланс и тепловой режим земной поверхности и атмосферы
- •Инсоляция. Отражение и поглощение света
- •2.5 Ионосфера
- •2.6 Химические превращения в атмосферном воздухе
- •2.7 Радиационный и тепловой балансы поверхности Земли
- •2.8 Источники загрязнения атмосферы
- •2.9 Аэрозольное загрязнение атмосферы
- •2.10 "Кислотные дожди"
- •2.11 Озон в атмосфере. Озоновый слой планеты
- •2.12 Химия парникового эффекта
- •Физик0-химические свойства гидросферы. Трансформация загрязнителей в ней
- •3.1 Общие сведения о гидросфере
- •Классификация питьевых минеральных вод. В зависимости от общей минерализации минеральные воды классифицируются на:
- •3.2 Химический состав природных вод
- •3.3 Характеристика химических показателей качества воды
- •3.4 Физические свойства и строение воды
- •3.5 Факты, ухудшающие состояние водных объектов
- •3.6 Загрязнение вод тяжелыми металлами
- •4. Физик0-химические процессы в литосфере. Загрязнения почв
- •4.1 Общие сведения о литосфере
- •4.2 Почва, ее состав и строение
- •4.3 Водно-физические свойства почвы
- •4.5 Механизмы катионного обмена, особенности адсорбции
- •4.6 Тяжелые металлы
- •4.8 Антропогенное воздействие на почву и литосферу
- •4.9 Источники загрязнения литосферы
- •4.10 Пестициды
- •4.11 Поведение радионуклидов в почвах
- •4.12 Загрязнение почв нефтью
- •4.13 Процессы биологического разложения твердых бытовых отходов
- •5 . Миграция загрязнителей атмосферы, гидросферы и литосферы. Биотический перенос загрязнителей.
- •5.1 Миграция загрязнителей атмосферы, гидросферы и литосферы
- •5.2 Особенности миграции радионуклидов и прогнозирование радиоактивного загрязнения местности
- •5.3 Перенос и трансформация загрязнителей в биосфере
- •5.4 Аккумуляция и рассеяние веществ в ландшафте
- •6. Ионизирующее излучение и окружающая среда
- •Общие понятия о ионизирующем излучении
- •6.2 Электромагнитное излучение
- •6.3 Геомагнитное и электрическое поле Земли
- •6.4 Искусственные радионуклиды в морских экосистемах
2.10 "Кислотные дожди"
Термином "кислотные дожди" называют все виды метеорологических осадков - дождь, снег, град, туман, дождь со снегом, - рН которых меньше, чем среднее значение рН дождевой воды (средний рН для дождевой воды равняется 5.6). Выделяющиеся в процессе человеческой деятельности двуокись серы (SO2) и окислы азота (NОx) трансформируются в атмосфере земли в кислотообразующие частицы. Эти частицы вступают в реакцию с водой атмосферы, превращая ее в растворы кислот, которые и понижают рН дождевой воды. Впервые термин «кислотный дождь» был введен в 1872 году английским исследователем Ангусом Смитом. Кислотные дожди разрушают здания и памятники культуры, трубопроводы, приводят в негодность автомобили, понижают плодородие почв и могут приводить к просачиванию токсичных металлов в водоносные слои почвы.
Вода обычного дождя тоже представляет собой слабокислый раствор. Это происходит вследствие того, что природные вещества атмосферы, такие как двуокись углерода (СО2), вступают в реакцию с дождевой водой. При этом образуется слабая угольная кислота (CO2 + H2O —> H2CO3). Тогда как в идеале рН дождевой воды равняется 5.6 -5.7, в реальной жизни показатель кислотности (рН) дождевой воды в одной местности может отличаться от показателя кислотности дождевой воды в другой местности. Это, прежде всего, зависит от состава газов, содержащихся в атмосфере той или иной местности, таких как оксид серы и оксиды азота.
Механизм образования кислотных дождей. Когда электростанции и промышленные предприятия сжигают уголь и нефть, из их дымовых труб выбрасываются огромные количества диоксида серы, взвешенных частиц и оксидов азота. По мере того как выбросы диоксида серы и оксида азота из стационарных источников переносятся ветром на большие расстояния, из них образуются вторичные загрязнители, такие, как диоксид азота, пары азотной кислоты и капельки, содержащие растворы серной кислоты, сульфатных и нитратных солей. Эти химические вещества попадают на земную поверхность в виде кислотных дождей или снега, а также в виде газов, тумана, росы или твердых частиц. Эти газы могут непосредственно поглощаться листьями. Комбинация сухих и мокрых осаждений и поглощения кислот и кислотообразующих веществ вблизи земной поверхности или на ней называются кислотными осадками, или кислотными дождями (рис. 21).
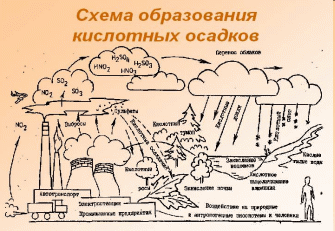
18 - Схема образования кислотных осадков
Еще одной причиной кислотных осадков являются выбросы оксида азота большим числом автомобилей в крупных городах. Такой вид загрязнения представляет опасность как для городских, так и для сельских районов. Так как капли воды и большинство твердых частиц довольно быстро удаляются из атмосферы, кислотные осадки являются скорее региональной или континентальной, чем глобальной проблемой.
Различные уровни кислотности и щелочности водных растворов обычно выражаются в единицах рН (рис. 4-7, с. 105, т. 2). В нейтральных растворах рН=7; в щелочных, или основных, рН > 7,а в кислых рН < 7. Чем меньше величина рН, тем более кислый раствор. Снижение рН на каждую единицу соответствует десятикратному возрастанию кислотности.
Кислотный дождь образуется в результате реакции между водой и такими загрязняющими веществами, как оксид серы (SO2) и различными оксидами азота (NOх). Эти вещества выбрасываются в атмосферу автомобильным транспортом, в результате деятельности металлургических предприятий и электростанций, а также при сжигании угля и древесины. Вступая в реакцию с водой атмосферы, они превращаются в растворы кислот - серной, сернистой, азотистой и азотной. Затем, вместе со снегом или дождем, они выпадают на землю.
Сухое и влажное осаждение кислот. В принципе имеются два альтернативных варианта подхода к проблеме кислотных дождей. Один из них базируется на утверждениях, что антропогенная деятельность является причиной выпадения кислотных дождей. Эта проблема возникла во второй половине XX в. и обусловлена главным образом чрезмерным выбросом в атмосферу окислов азота и сернистого газа. Кислотные дожди экологически опасны в силу их отрицательного влияния на любые экосистемы.
Второй вариант базируется на утверждениях, что исследования исторических данных не обнаруживают тенденций их изменения, что взаимосвязь между выбросами , а также NOх и степенью кислотности атмосферных осадков значительно слабее предполагаемой и что взаимосвязь между кислотными дождями и экологическим ущербом проявляется в значительно меньшей степени или даже почти отсутствует.
Рассмотрим первый вариант. Примем следующие четыре исходных положения:
- большие количества атмосферных загрязнений, выделяющихся за счет сгорания топлива, промышленного производства и широкого применения химикатов, определяют большие потоки первичных кислых примесей, которые могут вносить существенный вклад в кислотность атмосферы;
- среднее время существования загрязнений зависит от многих факторов, в частности от стабильности атмосферы, частоты выпадения осадков, присутствия индивидуальных компонентов атмосферы и т.д.;
- большинство загрязнений остается в пределах нижней части тропосферы и относительно равномерно распределено внутри перемешивающегося слоя;
- увеличение потоков кислотности к поверхности земли возникает за счет атмосферных осадков с повышенной кислотностью ("мокрое осаждение") и за счет адсорбции и выпадения в осадок газов и аэрозолей ("сухое осаждение").
Газовые выбросы от производственных процессов, широкомасштабное применение минеральных удобрений, пестицидов, растворителей, фреонов, использование ископаемых видов топлива для производства тепла и энергии, включая двигатель внутреннего сгорания, являются основными источниками загрязнения атмосферы. При этом и NOх считаются главными предшественниками кислотных дождей после превращения в серную и азотную кислоты. Надо сказать, что выяснение механизма окисления первичных загрязнений - , NOх, HCl - весьма сложная физико-химическая задача, хотя и представляет собой наиболее интересный аспект атмосферной кислотности. Достаточно указать на то, что процесс превращения диоксида серы в сульфат в атмосфере протекает различными путями и приводит к образованию различных продуктов окисления: и т.д.
Наконец, третий процесс связан с переносом сильных кислот и их солей к поверхности земли посредством сухого или мокрого осаждения.
Сухое осаждение - это прямой перенос с последующей адсорбцией газов и частиц природными поверхностями (растительностью, водой, почвой).
Мокрое осаждение - косвенный перенос некоторых частиц из атмосферы к поверхности земли с дождем, снегом или градом внутри или на поверхности частиц соответствующих видов осадков. Общая картина для кислых и основных компонентов, принимающих участие в химических равновесиях, реализуемых в каплях дождя, приведена на рис. 19 .
Переходя к рассмотрению результатов воздействия кислотных дождей на качество окружающей среды, необходимо, прежде всего, указать на многоплановость этого воздействия. Однако если даже ограничиться лишь несколькими конкретными примерами, то, очевидно, и этого будет достаточно, чтобы получить вполне определенное представление о характере воздействия. Одним из таких примеров может служить влияние кислотных дождей на содержание алюминия в почве.

Рисунок 19 - Схема модели возникновения кислотных дождей в атмосфере
Многочисленные исследования указывают на значительный рост геохимической подвижности алюминия в почвах и водоемах, подвергшихся выпадению кислотных дождей. Результатом этого является неуклонное возрастание концентрации алюминия, которое совместно со снижением рН представляет серьезную опасность для рыбы и других форм аквафлоры.
Переходя к рассмотрению результатов воздействия кислотных дождей на качество окружающей среды, необходимо, прежде всего, указать на многоплановость этого воздействия. Однако если даже ограничиться лишь несколькими конкретными примерами, то, очевидно, и этого будет достаточно, чтобы получить вполне определенное представление о характере воздействия. Одним из таких примеров может служить влияние кислотных дождей на содержание алюминия в почве.
Многочисленные исследования указывают на значительный рост геохимической подвижности алюминия в почвах и водоемах, подвергшихся выпадению кислотных дождей. Результатом этого является неуклонное возрастание концентрации алюминия, которое совместно со снижением рН представляет серьезную опасность для рыбы и других форм аквафлоры.
Алюминий как один из распространенных элементов обычно связан в недоступной форме в фазе почвенных минералов. С помощью эксперимента по моделированию кислотного дождя можно доказать, что подкисление переводит Аl из твердой почвы в фазу раствора, причем увеличение геохимической подвижности зависит от количества и природы присутствующих в почве органических лигандов (например, гуминовых и фульвовых кислот).
Результаты эксперимента по моделированию кислотного дождя показывают, что подкисление может высвободить Аl из твердой почвенной фазы в фазу раствора (К>K'), и увеличение мобильности зависит от количества и природы органических лигандов в почве.
Лиганды (от лат. ligo - связываю), нейтральные молекулы, ионы или радикалы, связанные с центр. атомом комплексного соединения. Ими могут быть ионы (Н-, Наl-, NO3-, NCS- и др.), неорганические молекулы (Н2, Сn, N2, Рn, О2, Sn, СО, СО2, NH3, NO, SO2, NO2, COS и др.), органические соединения, содержащие элементы главных подгрупп V, VI, VII гр. периодической системы.
|
|
Как свидетельствуют результаты экспериментов и литературные данные, чем больше количество сильносвязывающих лигандов, тем больше увеличивается подвижность Аl. Такие лиганды распространены в верхних горизонтах больше, чем в нижних. В настоящее время неоспоримо доказано, что алюминий - это реальный токсический агент в озерной воде и подкисленных водосборных площадях, причем этот металл выщелачивается в больших количествах из почв при подкислении. Алюминийсодержащая буферная система может замещать обычную гидрокарбонатную буферную систему, когда озера подкислены, и при рН, близких к 5, максимальная токсичность алюминия приводит к высокой смертности рыб.
Кислотный дождь оказывает отрицательное воздействие на водоемы - озера, реки, заливы, пруды - повышая их кислотность до такого уровня, что в них погибает флора и фауна. Водяные растения лучше всего растут в воде со значениями рН между 7 и 9.2. С увеличением кислотности (показатели рН удаляются влево от точки отсчета 7) водяные растения начинают погибать, лишая других животных водоема пищи. При кислотности рН 6 погибают пресноводные креветки. Когда кислотность повышается до рН 5.5, погибают донные бактерии, которые разлагают органические вещества и листья, и органический мусор начинает скапливаться на дне. Затем гибнет планктон - крошечное животное, которое составляет основу пищевой цепи водоема и питается веществами, образующимися при разложении бактериями органических веществ. Когда кислотность достигает рН 4.5, погибает вся рыба, большинство лягушек и насекомых.
Кислотный дождь наносит вред не только водной флоре и фауне. Он также уничтожает растительность на суше. Ученые считают, что хотя до сегодняшнего дня механизм до конца еще не изучен, сложная смесь загрязняющих веществ, включающая кислотные осадки, озон, и тяжелые металлы в совокупности приводят к деградации лесов.
Имитационная модель возникновения кислотных дождей в атмосфере описывает различные источники выбросов соединений серы и азота в атмосферу, химические реакции, в результате которых в атмосфере образуются серная и азотная кислоты и влияние кислотных осадков на природные экосистемы и человека. Также рассматривается ряд мероприятий по снижению образования кислотных дождей в атмосфере. На входе модели рассматриваются различные источники поступления окислов серы и азоты. Эти источники могут иметь как природное, так и антропогенное происхождение. Вклад антропогенных источников в образование кислотных дождей во много раз превышает вклад природных источников. Поэтому необходимо применение мер по снижению именно антропогенных выбросов окислов серы и азота в атмосферу. Смотреть рисунок-схему ниже.
Показателем влияния кислотных дождей является подкисление воды. Имеется убедительное доказательство уменьшения величины рН пресной воды за последние десятилетия; причем подкисление, наблюдаемое на различных водных участках, хорошо согласуется с изменениями состава осадков. Замечено, что во множестве кислых рек и озер происходит интенсивный рост водорослей и мхов. Многие водоросли в процессе фотосинтеза неактивны. Накопление водорослей при низких значениях рН, вероятно, обусловлено меньшим разложением и уменьшением поедания беспозвоночными животными. Минерализация водных организмов в кислых растворах замедляется, что приводит к накоплению вещества на дне озер и увеличению скорости образования мхов. Плотные студенистые грибковые подстилки уменьшают количество кислорода, необходимого для аэробного разложения. В конечном счете уменьшается возврат в цикл фосфора, который имеет большое значение для продуктивности озер. Нельзя не отметить, что при всем этом имеет место также изменение донных беспозвоночных, составляющих пищу для рыб и весьма чувствительных индикаторов изменения рН. Так, при рН ниже 4,5 не обнаруживаются никакие ракообразные, улитки, мидии, и при этом не может жить никакая имеющая промысловое значение пресноводная рыба.
Наконец, показательным примером может служить влияние кислотных дождей на архитектурные сооружения и памятники. Обычные материалы для каменной кладки - это известняк, мрамор, песчаники, базальт, гранит. Кроме того, используются и искусственные материалы, такие, как кирпич, бетон, различные известковые растворы. Хорошо известно, что эти материалы в основном состоят из карбонатов и силикатов, все обладают высокой чувствительностью к воздействию кислых осаждений и к присутствию атмосферного. Так, например, если взять мрамор, то под действием указанных химических агентов протекают реакции. Основной реакцией, ответственной за разрушение мрамора и повреждения памятников, является образование сульфата, которое происходит на поверхности этих материалов. При этом окисление до происходит за счет каталитического действия таких поверхностных примесей, как , копоть, влага, а также благодаря окисляющим серу бактериям. Обобщение большой информации, в том числе и рассмотренной выше, позволяет сделать ряд далеко идущих выводов о влиянии кислотных дождей на окружающую среду. В частности, можно утверждать, что:
- кислотный дождь изменяет величину рН рек и озер и может вызвать их биологическую смерть;
- при поглощении почвами кислотный дождь выщелачивает основные природные минералы (калий, кальций, магний) и, унося их в подпочвенный слой, лишает деревья и растения питательных веществ;
- под влиянием кислотных дождей возрастает геохимическая подвижность алюминия, приводящая одновременно со снижением рН к возрастанию его концентраций и изменению его токсичных форм;
- кислотные дожди способствуют разрушению каменной кладки, а также архитектурных сооружений и памятников.
Как уже отмечалось, к проблеме кислотных дождей имеются два противоположных подхода. Переходя к рассмотрению варианта, альтернативного предыдущему, необходимо подчеркнуть, что, по утверждению некоторых американских ученых, этот вариант представляет новый взгляд на проблему кислотных дождей. В соответствии с ним общепринятое мнение о том, что причиной кислотного дождя, а следовательно и экологического ущерба, является повышенное содержание и NOx в газовых выбросах, основано на ограниченном отборе данных и не подкреплено доказательствами с привлечением более широких доступных сведений. Чтобы понять суть данного подхода, целесообразно проследить взаимосвязь между выбросами и кислотностью дождей в какой-либо части планеты. Когда все внимание сосредоточено на содержании выбросов и сульфатов в атмосферных осадках, то кажется возможным принять, что сульфат является основным признаком кислотности в атмосферных осадках и выразителем концентрации водородных ионов. Между тем в действительности для корректного определения кислотности дождя с помощью химических методов требуется учет по меньшей мере восьми видов ионов: трех анионов, активирующих кислоту (сульфата, нитрата, хлорида), и пяти катионов, нейтрализующих кислоту (калия, натрия, кальция, магния, аммония). Выраженная в микроэквивалентах на 1 л разность между суммами анионов и катионов определяется как концентрация водородных ионов или кислотность:
