
- •Часть I
- •Содержание
- •Введение
- •Вводный блок основы математической обработки экспериментальных данных
- •1. Элементы теории вероятности и математической статистики
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •2. Ошибки измерений
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •3. Округление чисел
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •4. Построение графиков
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •5. Расчет коэффициентов прямой
- •Задачи и упражнения для самостоятельного решения
- •6. Линеаризация
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •7. Нахождение производных и интегрирование
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •1. Физическая химия модуль 1 термодинамика. Термохимия
- •1.1. Основные понятия и законы термодинамики. Термохимия
- •1.1.1. Первое начало термодинамики Основные уравнения
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •1.1.2. Термохимия Основные уравнения
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •1.1.3. Второе начало термодинамики. Энтропия Основные уравнения
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •1.1.4. Термодинамические потенциалы. Функции Гиббса, Гельмгольца Основные уравнения
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •1.2. Термодинамика химического равновесия
- •1.2.1. Изотерма химической реакции. Расчет констант равновесия химических реакций по термодинамическим таблицам Основные уравнения
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •1.2.2. Зависимость констант равновесия реакций от температуры. Расчет равновесного выхода продуктов реакции Основные уравнения
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •Модуль 2 химическое равновесие. Фазовые равновесия
- •1.3. Термодинамика фазовых равновесий
- •1.3.1. Фазовые равновесия в однокомпонентных системах. Правило фаз Гиббса. Уравнения Клапейрона, Клапейрона – Клаузиуса Основные уравнения
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •1.3.2. Фазовые равновесия в двухкомпонентных системах, перегонка Основные уравнения
- •Равновесие «твердое вещество – жидкость». Фазовая диаграмма системы с простой эвтектикой
- •Системы с ограниченной растворимостью в жидкой фазе (расслаивающиеся жидкости)
- •Перегонка с водяным паром
- •1.3.3. Фазовые равновесия в трехкомпонентных системах. Экстракция
- •П римеры решения типовых задач
- •Задачи для самостоятельного решения
- •Модуль 3 коллигативные свойства растворов. Электрохимия
- •1.4. Термодинамика разбавленных растворов, взаимосвязь между коллигативными свойствами
- •1.4.1. Давление пара растворителя над разбавленными растворами. Закон Рауля Основные уравнения
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.4.2. Осмотическое давление растворов Основные уравнения
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.4.3. Криоскопия. Эбуллиоскопия Основные уравнения Криоскопия
- •Эбулиоскопия
- •Экспериментальные методы определения молярных масс и изотонического коэффициента методом эбуллиоскопии и криоскопии
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.5. Термодинамика растворов электролитов
- •1.5.1. Теория растворов сильных электролитов Дебая – Хюккеля Основные уравнения
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.5.2. Буферные системы и растворы Основные уравнения
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.6. Электрохимия
- •1.6.1. Электропроводность растворов электролитов Основные уравнения
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.6.2. Электродные потенциалы и электродвижущие силы гальванических элементов
- •1.6.2.1. Электроды и электродные потенциалы Основные уравнения
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.6.2.2. Гальванические элементы и эдс Основные уравнения
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Модуль 4 кинетика химических реакций и катализ
- •1.7. Кинетика химических реакций
- •1.7.1. Скорость реакции Основные уравнения Скорость реакции
- •Расчет скорости реакции по экспериментальным данным, заданным в виде таблицы
- •Расчет скорости реакции по экспериментальным данным, заданным в виде графика
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.7.2. Формальная кинетика необратимых реакций нулевого, первого, второго порядков Основные уравнения Основной постулат химической кинетики – закон действия масс для кинетики
- •Молекулярность химической реакции
- •Реакция нулевого порядка
- •Реакция первого порядка
- •Реакция второго порядка
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Графический метод
- •Определение порядка реакции по периоду полупревращения
- •Дифференциальные методы Метод Вант-Гоффа
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.7.4. Зависимость скорости реакции от температуры Основные уравнения Правило Вант-Гоффа
- •Уравнение Аррениуса
- •Метод ускоренного определения срока годности лекарственных препаратов
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.7.5. Сложные реакции
- •Обратимые реакции
- •Параллельные реакции
- •Последовательные реакции
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •1.7.6. Ферментативный катализ
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Модуль 5 поверхностные явления и адсорбция
- •1.8. Поверхностные явления и адсорбция
- •1.8.1. Термодинамика поверхностного слоя Основные уравнения Поверхностная энергия Гиббса и поверхностное натяжение
- •Методы определения поверхностного натяжения на легкоподвижных границах фаз
- •Краевой угол смачивания
- •Зависимость поверхностного натяжения от температуры. Связь поверхностной энергии Гиббса и поверхностной энтальпии
- •Энтальпия смачивания и коэффициент гидрофильности
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.8.2. Адсорбция на границе «жидкость – газ» Основные уравнения Уравнение изотермы адсорбции Гиббса
- •Изотерма поверхностного натяжения
- •Поверхностно-активные, поверхностно-инактивные вещества, их молекулярное строение
- •Ориентация молекул в поверхностном слое
- •Адсорбция на границе «жидкость – газ». Уравнение Ленгмюра
- •Определение площади, занимаемой молекулой поверхностно-активного вещества в насыщенном адсорбционном слое, и максимальной длины молекулы пав
- •Уравнение Шишковского
- •Правило Дюкло – Траубе
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.8.3. Адсорбция на границе «твердое тело – газ» и «твердое тело – жидкость» Основные уравнения Мономолекулярная адсорбция, уравнение изотермы адсорбции Лэнгмюра, Фрейндлиха
- •Полимолекулярная адсорбция
- •Капиллярная конденсация
- •Адсорбция электролитов. Неспецифическая (эквивалентная) адсорбция ионов. Избирательная адсорбция ионов. Правило Панета – Фаянса
- •Ионный обмен. Иониты и их классификация. Обменная емкость. Применение ионитов в фармации
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Предметный указатель
- •Приложение
- •1. Основные единицы измерения физических величин
- •2. Основные физические постоянные
- •3. Основные математические формулы дифференциального и интегрального исчисления
- •Основные правила дифференцирования
- •Основные правила интегрирования Неопределенный интеграл:
- •Определенный интеграл:
- •4. Критические значения коэффициента Стьюдента t
- •6. Стандартные энтальпии плавления и испарения при температуре фазового перехода
- •7. Константы Генри (Па) при 25с
- •8. Криоскопические и эбуллиоскопические константы
- •9. Термодинамические свойства простых веществ, ионов и соединений
- •Простые вещества и ионы
- •Неорганические соединения
- •Органические соединения Углеводороды
- •Кислородсодержащие соединения
- •Галогенсодержащие соединения
- •Азотсодержащие соединения
- •10. Теплота сгорания питательных веществ в живом организме и в калориметре
- •11. Криоскопические и эбуллиоскопические константы
- •12. Удельная электрическая проводимость растворов kCl
- •13. Предельные молярные подвижности ионов в водном растворе при 25°с
- •14. Молярная электропроводность разбавленных водных растворов электролитов при 25°с
- •15. Константы диссоциации слабых кислот при 25°с
- •16. Константы диссоциации слабых оснований при 25°с
- •17. Стандартные электродные потенциалы при 25°с
- •18. Основные физические постоянные
- •19. Плотность пав в жидком состоянии
- •20. Зависимость поверхностного натяжения воды от температуры
- •Литература
Адсорбция электролитов. Неспецифическая (эквивалентная) адсорбция ионов. Избирательная адсорбция ионов. Правило Панета – Фаянса
В зависимости от природы адсорбента процессы адсорбции ионов электролитов подразделяются на ионную адсорбцию и ионный обмен.
Ионная адсорбция заключается в адсорбции ионов из растворов электролитов на поверхности твердых веществ, кристаллическая решетка которых состоит из ионов или полярных молекул, то есть на полярных адсорбентах. Ионная адсорбция имеет ряд характерных особенностей.
На адсорбции ионов существенным образом сказывается природа адсорбента. Ионы, способные поляризоваться, адсорбируются обычно только на поверхностях, состоящих из полярных молекул или из ионов. Поэтому ионную адсорбцию часто называют также полярной адсорбцией. Микроучастки поверхности, несущие определенный заряд, адсорбируют противоположно заряженные ионы. При этом ионы электролита, несущие противоположный знак, непосредственно не адсорбируются, но под действием сил электростатического притяжения остаются вблизи адсорбированных ионов, образуя с ними на поверхности адсорбента так называемый двойной электрический слой.
Радиус ионов сильно влияет на их способность адсорбироваться. Из ионов одинаковой валентности максимальную адсорбционную способность проявляют ионы наибольшего радиуса. Причина этого явления, с одной стороны, заключается в большой поляризуемости таких ионов и, следовательно, их способности притягиваться поверхностью, состоящей из ионов или полярных молекул, с другой стороны, в меньшей гидратации ионов (чем больше радиус иона, тем меньше при одном и том же заряде его гидратация). Гидратация вообще препятствует адсорбции ионов, так как наличие гидратной оболочки уменьшает электрическое взаимодействие. По величине адсорбции ионы располагаются в так называемые лиотропные ряды, которые для водных систем выглядят так:
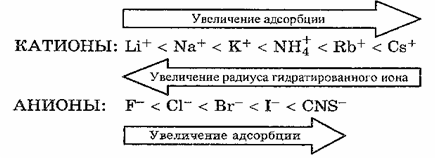
Многозарядные ионы адсорбируются лучше однозарядных, исключение составляет катион водорода:
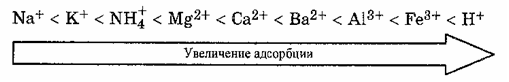
Если в растворе электролита имеются такие же ионы, как и в составе твердого адсорбента, то ионная адсорбция принимает строго избирательный характер, описываемый правилом Панета – Фаянса – Пескова об избирательной ионной адсорбции: на поверхности кристалла преимущественно адсорбируются те ионы, которые входят в состав кристаллической решетки адсорбента или изоморфны им по строению и могут достроить кристаллическую решетку. Ионная адсорбция не всегда обратима, так как она может сопровождаться хемосорбцией, приводящей, например, к образованию малорастворимого вещества.
Ионный обмен. Иониты и их классификация. Обменная емкость. Применение ионитов в фармации
Ионный обмен протекает на тех адсорбентах, которые являются полиэлектролитами (ионообменники, иониты, ионообменные смолы).
Ионный обменом называется процесс эквивалентного обмена ионов, находящихся в ионообменнике, на другие ионы того же знака, находящиеся в растворе. Процесс ионного обмена обратим.
Иониты подразделяются на катиониты, аниониты и амфотерные иониты.
Катиониты – вещества, содержащие в своей структуре фиксированные отрицательно заряженные группы (фиксированные ионы), около которых находятся подвижные катионы (противоионы), которые могут обмениваются с катионами, находящимися в растворе (рис. 81).
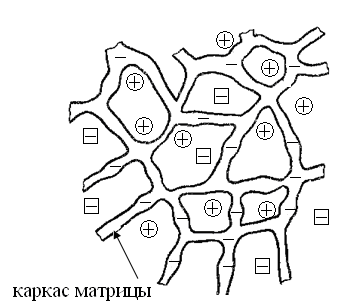
Рис. 81. Модель матрицы полиэлектролита (катионита) с фиксированными анионами и подвижными противоионами, где – – фиксированные ионы;
![]() –
коионы,
–
коионы,
![]() –
противоионы
–
противоионы
Различают природные катиониты: цеолиты, пермутиты, силикагель, целлюлоза, а также искусственные: высокомолекулярные твердые нерастворимые ионогенные полимеры, содержащие чаще всего сульфогруппы, карбоксильные, фосфиновокислые, мышьяковокислые или селеновокислые группы. Реже применяются синтетические неорганические катиониты, являющиеся чаще всего алюмосиликатами.
По степени ионизации ионогенных групп катиониты делят на сильнокислотные и слабокислотные. Сильнокислотные катиониты способны обменивать свои подвижные катионы на внешние катионы в щелочной, нейтральной и кислой средах. Слабокислотные катиониты обменивают противоионы на другие катионы только в щелочной среде. К сильнокислотным относят катиониты с сильно диссоциированными кислотными группами – сульфокислотными. К слабокислотным относят катиониты, содержащие слабодиссоциированные кислотные группы – фосфорнокислотные, карбоксильные, оксифенильные.
Аниониты– ионообменники, которые содержат в своей структуре положительно заряженные ионогенные группы (фиксированные ионы), около которых находятся подвижные анионы (противоионы), которые могут обмениваться с анионами, находящимися в растворе (рис. 82). Различают природные и синтетические аниониты.
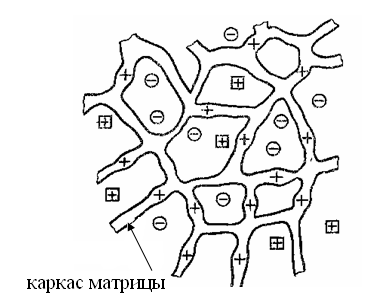
Рис. 82. Модель матрицы полиэлектролита (анионита) с фиксированными катионами и подвижными противоионами, где + – фиксированные ионы;
![]() –
коионы,
–
коионы,
![]() –
противоионы
–
противоионы
Синтетические аниониты содержат в макромолекулах положительно заряженные ионогенные группы. Слабоосновные аниониты имеют в своем составе первичные, вторичные и третичные аминогруппы, сильноосновные аниониты содержат группы четвертичных ониевых солей и оснований (аммониевых, пиридиниевых, сульфониевых, фосфониевых). Сильноосновные аниониты обменивают подвижные анионы в кислой, нейтральной и щелочной средах, слабоосновные – только в кислой среде.
Амфотерные иониты содержат и катионные, и анионные ионогенные группы. Эти иониты могут сорбировать одновременно и катионы и анионы.
Количественной характеристикой ионита является полная обменная емкость (ПОЕ). Определение ПОЕ можно осуществить статическим или динамическим методом, основанном на реакциях, протекающих в системе «ионит – раствор»:
RSO3–H+ + NaOH → RSO3–Na+ + H2O
RNH3+OH– + HCl → RNH3+Cl– + H2O
Емкость определяется числом ионогенных групп в ионите и поэтому теоретически должна быть постоянной величиной. Однако практически она зависит от ряда условий. Различают статическую обменную емкость (СОЕ) и динамическую обменную емкость (ДОЕ). Статическая обменная емкость — полная емкость, характеризующая общее количество ионогенных групп (в миллиэквивалентах), приходящихся на единицу массы воздушно-сухого ионита или нa единицу объема набухшего ионита. Природные иониты имеют небольшую статическую обменную емкость, не превышающую 0,2—0,3 мэкв/г. Для синтетических ионообменных смол она находится в пределах 3—5 мэкв/г, а иногда достигает 10,0 мэкв/г.
Динамическая, или рабочая, обменная емкость относится только к той части ионогеппых групп, которые участвуют в ионном обмене, протекающем в технологических условиях, например, в ионообменной колонке при определенной относительной скорости движения ионита и раствора. Динамическая емкость зависит от скорости движения, размеров колонки и других факторов и всегда меньше статической обменной емкости.
Для определения статической обменной емкости ионитов применяют различные методы. Все эти методы сводятся к насыщению ионита каким-либо ионом, затем вытеснению его другим ионом и анализу первого в растворе. Например, катионит удобно полностью перевести в Н+-форму (противоионами являются ионы водорода), затем промыть его раствором хлорида натрия и полученный кислый раствор оттитровать раствором щелочи. Емкость равна отношению количества перешедшей в раствор кислоты к навеске ионита.
При статическом методе титруют кислоту или щелочь, которые в результате ионообменной адсорбции появляются в растворе.
При динамическом методе ПОЕ определяется с помощью хроматографических колонок. Через колонку, заполненную ионообменной смолой, пропускают раствор электролита и регистрируют зависимость концентрации поглощаемого иона в выходящем растворе (элюате) от объема прошедшего раствора (выходная кривая). ПОЕ рассчитывают по формуле
|
(337) |
где Vобщ – суммарный объем раствора, содержащий вытесненную из смолы кислоту; с – концентрация кислоты в этом растворе; m – масса ионообменной смолы в колонке.
Константу равновесия ионного обмена можно определить из данных о равновесном распределении ионов в статических условиях (равновесное состояние при ионном обмене описывается законом действия масс), а также динамическим методом по скорости перемещения зоны вещества по слою смолы (элюентная хроматография).
Для реакции ионного обмена
![]()
константа равновесия равна
|
(338) |
где
![]() ,
,
![]() – концентрация ионов в ионите;
– концентрация ионов в ионите;
![]() ,
,
![]() – концентрация ионов в растворе.
– концентрация ионов в растворе.
Применяя иониты, можно умягчить воду или опреснять засоленную воду и получать пригодную для фармацевтических целей. Другое применение ионообменной адсорбции в фармации состоит в использовании его для аналитических целей как метода извлечения из смесей того или другого анализируемого компонента.
