
- •Часть I
- •Содержание
- •Введение
- •Вводный блок основы математической обработки экспериментальных данных
- •1. Элементы теории вероятности и математической статистики
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •2. Ошибки измерений
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •3. Округление чисел
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •4. Построение графиков
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •5. Расчет коэффициентов прямой
- •Задачи и упражнения для самостоятельного решения
- •6. Линеаризация
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •7. Нахождение производных и интегрирование
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •1. Физическая химия модуль 1 термодинамика. Термохимия
- •1.1. Основные понятия и законы термодинамики. Термохимия
- •1.1.1. Первое начало термодинамики Основные уравнения
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •1.1.2. Термохимия Основные уравнения
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •1.1.3. Второе начало термодинамики. Энтропия Основные уравнения
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •1.1.4. Термодинамические потенциалы. Функции Гиббса, Гельмгольца Основные уравнения
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •1.2. Термодинамика химического равновесия
- •1.2.1. Изотерма химической реакции. Расчет констант равновесия химических реакций по термодинамическим таблицам Основные уравнения
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •1.2.2. Зависимость констант равновесия реакций от температуры. Расчет равновесного выхода продуктов реакции Основные уравнения
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •Модуль 2 химическое равновесие. Фазовые равновесия
- •1.3. Термодинамика фазовых равновесий
- •1.3.1. Фазовые равновесия в однокомпонентных системах. Правило фаз Гиббса. Уравнения Клапейрона, Клапейрона – Клаузиуса Основные уравнения
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •1.3.2. Фазовые равновесия в двухкомпонентных системах, перегонка Основные уравнения
- •Равновесие «твердое вещество – жидкость». Фазовая диаграмма системы с простой эвтектикой
- •Системы с ограниченной растворимостью в жидкой фазе (расслаивающиеся жидкости)
- •Перегонка с водяным паром
- •1.3.3. Фазовые равновесия в трехкомпонентных системах. Экстракция
- •П римеры решения типовых задач
- •Задачи для самостоятельного решения
- •Модуль 3 коллигативные свойства растворов. Электрохимия
- •1.4. Термодинамика разбавленных растворов, взаимосвязь между коллигативными свойствами
- •1.4.1. Давление пара растворителя над разбавленными растворами. Закон Рауля Основные уравнения
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.4.2. Осмотическое давление растворов Основные уравнения
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.4.3. Криоскопия. Эбуллиоскопия Основные уравнения Криоскопия
- •Эбулиоскопия
- •Экспериментальные методы определения молярных масс и изотонического коэффициента методом эбуллиоскопии и криоскопии
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.5. Термодинамика растворов электролитов
- •1.5.1. Теория растворов сильных электролитов Дебая – Хюккеля Основные уравнения
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.5.2. Буферные системы и растворы Основные уравнения
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.6. Электрохимия
- •1.6.1. Электропроводность растворов электролитов Основные уравнения
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.6.2. Электродные потенциалы и электродвижущие силы гальванических элементов
- •1.6.2.1. Электроды и электродные потенциалы Основные уравнения
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.6.2.2. Гальванические элементы и эдс Основные уравнения
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Модуль 4 кинетика химических реакций и катализ
- •1.7. Кинетика химических реакций
- •1.7.1. Скорость реакции Основные уравнения Скорость реакции
- •Расчет скорости реакции по экспериментальным данным, заданным в виде таблицы
- •Расчет скорости реакции по экспериментальным данным, заданным в виде графика
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.7.2. Формальная кинетика необратимых реакций нулевого, первого, второго порядков Основные уравнения Основной постулат химической кинетики – закон действия масс для кинетики
- •Молекулярность химической реакции
- •Реакция нулевого порядка
- •Реакция первого порядка
- •Реакция второго порядка
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Графический метод
- •Определение порядка реакции по периоду полупревращения
- •Дифференциальные методы Метод Вант-Гоффа
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.7.4. Зависимость скорости реакции от температуры Основные уравнения Правило Вант-Гоффа
- •Уравнение Аррениуса
- •Метод ускоренного определения срока годности лекарственных препаратов
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.7.5. Сложные реакции
- •Обратимые реакции
- •Параллельные реакции
- •Последовательные реакции
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •1.7.6. Ферментативный катализ
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Модуль 5 поверхностные явления и адсорбция
- •1.8. Поверхностные явления и адсорбция
- •1.8.1. Термодинамика поверхностного слоя Основные уравнения Поверхностная энергия Гиббса и поверхностное натяжение
- •Методы определения поверхностного натяжения на легкоподвижных границах фаз
- •Краевой угол смачивания
- •Зависимость поверхностного натяжения от температуры. Связь поверхностной энергии Гиббса и поверхностной энтальпии
- •Энтальпия смачивания и коэффициент гидрофильности
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.8.2. Адсорбция на границе «жидкость – газ» Основные уравнения Уравнение изотермы адсорбции Гиббса
- •Изотерма поверхностного натяжения
- •Поверхностно-активные, поверхностно-инактивные вещества, их молекулярное строение
- •Ориентация молекул в поверхностном слое
- •Адсорбция на границе «жидкость – газ». Уравнение Ленгмюра
- •Определение площади, занимаемой молекулой поверхностно-активного вещества в насыщенном адсорбционном слое, и максимальной длины молекулы пав
- •Уравнение Шишковского
- •Правило Дюкло – Траубе
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.8.3. Адсорбция на границе «твердое тело – газ» и «твердое тело – жидкость» Основные уравнения Мономолекулярная адсорбция, уравнение изотермы адсорбции Лэнгмюра, Фрейндлиха
- •Полимолекулярная адсорбция
- •Капиллярная конденсация
- •Адсорбция электролитов. Неспецифическая (эквивалентная) адсорбция ионов. Избирательная адсорбция ионов. Правило Панета – Фаянса
- •Ионный обмен. Иониты и их классификация. Обменная емкость. Применение ионитов в фармации
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Предметный указатель
- •Приложение
- •1. Основные единицы измерения физических величин
- •2. Основные физические постоянные
- •3. Основные математические формулы дифференциального и интегрального исчисления
- •Основные правила дифференцирования
- •Основные правила интегрирования Неопределенный интеграл:
- •Определенный интеграл:
- •4. Критические значения коэффициента Стьюдента t
- •6. Стандартные энтальпии плавления и испарения при температуре фазового перехода
- •7. Константы Генри (Па) при 25с
- •8. Криоскопические и эбуллиоскопические константы
- •9. Термодинамические свойства простых веществ, ионов и соединений
- •Простые вещества и ионы
- •Неорганические соединения
- •Органические соединения Углеводороды
- •Кислородсодержащие соединения
- •Галогенсодержащие соединения
- •Азотсодержащие соединения
- •10. Теплота сгорания питательных веществ в живом организме и в калориметре
- •11. Криоскопические и эбуллиоскопические константы
- •12. Удельная электрическая проводимость растворов kCl
- •13. Предельные молярные подвижности ионов в водном растворе при 25°с
- •14. Молярная электропроводность разбавленных водных растворов электролитов при 25°с
- •15. Константы диссоциации слабых кислот при 25°с
- •16. Константы диссоциации слабых оснований при 25°с
- •17. Стандартные электродные потенциалы при 25°с
- •18. Основные физические постоянные
- •19. Плотность пав в жидком состоянии
- •20. Зависимость поверхностного натяжения воды от температуры
- •Литература
Адсорбция на границе «жидкость – газ». Уравнение Ленгмюра
Изотерма адсорбции Ленгмюра для раздела "жидкость – газ" и "жидкость – жидкость" имеет вид, приведенный на рисунке 71.
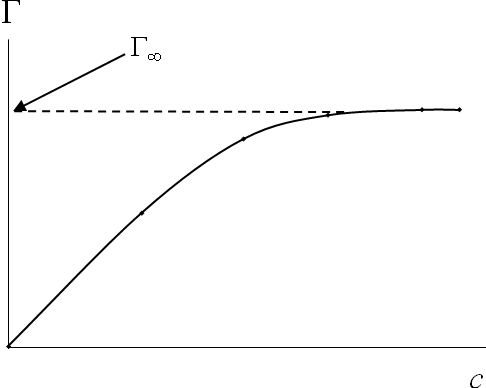
Рис. 71. Изотерма адсорбции Ленгмюра
Наибольшее и постоянное значение адсорбции Г, при котором достигается насыщение адсорбционного слоя и адсорбция уже не зависит концентрации, называют предельной адсорбцией Г. При больших концентрациях поверхностный слой насыщен молекулами растворенного вещества.
Для приближенных расчетов производную d/dc в уравнении Гиббса для адсорбции (310) можно заменить на
|
(312) |
Для объяснения зависимости адсорбции как на легкоподвижных границах, так и на границах с твердыми фазами И. Ленгмюр в 1915 г. предложил теорию мономолекулярной адсорбции. Уравнение мономолекулярной адсорбции для границы газ – жидкость имеет вид:
|
(313) |
где Г – предельная адсорбция в мономолекулярном слое (Г Г при с ); K – константа адсорбционного равновесия.
Величина константы равновесия адсорбции тем больше, чем сильнее выражено сродство данного адсорбируемого вещества к данному адсорбенту или чем больше работа адсорбции вещества на межфазной границе. Помимо природы адсорбента и адсорбата на величину K влияет температура. С повышением температуры усиливается процесс десорбции, так как возрастает кинетическая энергия молекул адсорбата и константа K уменьшается. Уравнение Ленгмюра (313) выражает зависимость адсорбции от равновесной концентрации вещества в объеме раствора при постоянной температуре и носят название уравнений изотермы адсорбции Ленгмюра. Помимо константы K в уравнение Ленгмюра входит постоянная Г, которая представляет собой предельное значение адсорбции. Величина Г зависит от размеров молекул адсорбата. Очевидно, что чем крупнее молекула адсорбата, тем больше площадь, приходящаяся на молекулу в адсорбционном слое, и тем меньше величина Г. Ее выражают числом молей адсорбата на единицу площади (моль/м2).
На изотерме адсорбции (рис. 71) можно выделить три участка: начальный, промежуточный и горизонтальный, идущий параллельно оси абсцисс.
Анализ уравнения Ленгмюра показывает, что в зависимости от концентрации адсорбата оно может принимать различный вид. При малых концентрациях, когда Kc << 1, этой величиной в знаменателе можно пренебречь и уравнение принимает вид
|
(314) |
При больших концентрациях, когда Kc >> 1, можно пренебречь единицей в знаменателе уравнения Ленгмюра (313), тогда Г = Г.
Для графического определения величин K и Г используют линейную форму уравнения Ленгмюра (315). Для линеаризации уравнения (313) найдем обратные величины от левой и правой части этого уравнения:
.
Разделим слагаемые в числителе правой части на знаменатель и проведем сокращения:
|
(315) |
Уравнение (315) имеет линейный вид у = ах+b, где
, , , .
График в координатах
![]() представляет собой прямую (рис. 72).
Ордината точки, получаемой при
экстраполяции прямой до вертикальной
прямой при с = 0, равна 1/Г.
представляет собой прямую (рис. 72).
Ордината точки, получаемой при
экстраполяции прямой до вертикальной
прямой при с = 0, равна 1/Г.
Константа адсорбционного равновесия K рассчитывается по графику (рис. 72): методом экстраполяции при х = 0 определяем коэффициент b в уравнении прямой y=ax+b. Используя координаты y1 и x1 точки 1, лежащей на прямой, рассчитываем коэффициент а по формуле (316):
. |
(316) |

Рис. 72. Графическое определение констант уравнения адсорбции Ленгмюра
Степенью заполнения поверхности адсорбатом называют величину
|
(317) |
Степень заполнения показывает, какая доля поверхности занята молекулами адсорбата.
