
- •Часть I
- •Содержание
- •Введение
- •Вводный блок основы математической обработки экспериментальных данных
- •1. Элементы теории вероятности и математической статистики
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •2. Ошибки измерений
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •3. Округление чисел
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •4. Построение графиков
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •5. Расчет коэффициентов прямой
- •Задачи и упражнения для самостоятельного решения
- •6. Линеаризация
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •7. Нахождение производных и интегрирование
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •1. Физическая химия модуль 1 термодинамика. Термохимия
- •1.1. Основные понятия и законы термодинамики. Термохимия
- •1.1.1. Первое начало термодинамики Основные уравнения
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •1.1.2. Термохимия Основные уравнения
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •1.1.3. Второе начало термодинамики. Энтропия Основные уравнения
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •1.1.4. Термодинамические потенциалы. Функции Гиббса, Гельмгольца Основные уравнения
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •1.2. Термодинамика химического равновесия
- •1.2.1. Изотерма химической реакции. Расчет констант равновесия химических реакций по термодинамическим таблицам Основные уравнения
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •1.2.2. Зависимость констант равновесия реакций от температуры. Расчет равновесного выхода продуктов реакции Основные уравнения
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •Модуль 2 химическое равновесие. Фазовые равновесия
- •1.3. Термодинамика фазовых равновесий
- •1.3.1. Фазовые равновесия в однокомпонентных системах. Правило фаз Гиббса. Уравнения Клапейрона, Клапейрона – Клаузиуса Основные уравнения
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •1.3.2. Фазовые равновесия в двухкомпонентных системах, перегонка Основные уравнения
- •Равновесие «твердое вещество – жидкость». Фазовая диаграмма системы с простой эвтектикой
- •Системы с ограниченной растворимостью в жидкой фазе (расслаивающиеся жидкости)
- •Перегонка с водяным паром
- •1.3.3. Фазовые равновесия в трехкомпонентных системах. Экстракция
- •П римеры решения типовых задач
- •Задачи для самостоятельного решения
- •Модуль 3 коллигативные свойства растворов. Электрохимия
- •1.4. Термодинамика разбавленных растворов, взаимосвязь между коллигативными свойствами
- •1.4.1. Давление пара растворителя над разбавленными растворами. Закон Рауля Основные уравнения
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.4.2. Осмотическое давление растворов Основные уравнения
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.4.3. Криоскопия. Эбуллиоскопия Основные уравнения Криоскопия
- •Эбулиоскопия
- •Экспериментальные методы определения молярных масс и изотонического коэффициента методом эбуллиоскопии и криоскопии
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.5. Термодинамика растворов электролитов
- •1.5.1. Теория растворов сильных электролитов Дебая – Хюккеля Основные уравнения
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.5.2. Буферные системы и растворы Основные уравнения
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.6. Электрохимия
- •1.6.1. Электропроводность растворов электролитов Основные уравнения
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.6.2. Электродные потенциалы и электродвижущие силы гальванических элементов
- •1.6.2.1. Электроды и электродные потенциалы Основные уравнения
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.6.2.2. Гальванические элементы и эдс Основные уравнения
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Модуль 4 кинетика химических реакций и катализ
- •1.7. Кинетика химических реакций
- •1.7.1. Скорость реакции Основные уравнения Скорость реакции
- •Расчет скорости реакции по экспериментальным данным, заданным в виде таблицы
- •Расчет скорости реакции по экспериментальным данным, заданным в виде графика
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.7.2. Формальная кинетика необратимых реакций нулевого, первого, второго порядков Основные уравнения Основной постулат химической кинетики – закон действия масс для кинетики
- •Молекулярность химической реакции
- •Реакция нулевого порядка
- •Реакция первого порядка
- •Реакция второго порядка
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Графический метод
- •Определение порядка реакции по периоду полупревращения
- •Дифференциальные методы Метод Вант-Гоффа
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.7.4. Зависимость скорости реакции от температуры Основные уравнения Правило Вант-Гоффа
- •Уравнение Аррениуса
- •Метод ускоренного определения срока годности лекарственных препаратов
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.7.5. Сложные реакции
- •Обратимые реакции
- •Параллельные реакции
- •Последовательные реакции
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •1.7.6. Ферментативный катализ
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Модуль 5 поверхностные явления и адсорбция
- •1.8. Поверхностные явления и адсорбция
- •1.8.1. Термодинамика поверхностного слоя Основные уравнения Поверхностная энергия Гиббса и поверхностное натяжение
- •Методы определения поверхностного натяжения на легкоподвижных границах фаз
- •Краевой угол смачивания
- •Зависимость поверхностного натяжения от температуры. Связь поверхностной энергии Гиббса и поверхностной энтальпии
- •Энтальпия смачивания и коэффициент гидрофильности
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.8.2. Адсорбция на границе «жидкость – газ» Основные уравнения Уравнение изотермы адсорбции Гиббса
- •Изотерма поверхностного натяжения
- •Поверхностно-активные, поверхностно-инактивные вещества, их молекулярное строение
- •Ориентация молекул в поверхностном слое
- •Адсорбция на границе «жидкость – газ». Уравнение Ленгмюра
- •Определение площади, занимаемой молекулой поверхностно-активного вещества в насыщенном адсорбционном слое, и максимальной длины молекулы пав
- •Уравнение Шишковского
- •Правило Дюкло – Траубе
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.8.3. Адсорбция на границе «твердое тело – газ» и «твердое тело – жидкость» Основные уравнения Мономолекулярная адсорбция, уравнение изотермы адсорбции Лэнгмюра, Фрейндлиха
- •Полимолекулярная адсорбция
- •Капиллярная конденсация
- •Адсорбция электролитов. Неспецифическая (эквивалентная) адсорбция ионов. Избирательная адсорбция ионов. Правило Панета – Фаянса
- •Ионный обмен. Иониты и их классификация. Обменная емкость. Применение ионитов в фармации
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Предметный указатель
- •Приложение
- •1. Основные единицы измерения физических величин
- •2. Основные физические постоянные
- •3. Основные математические формулы дифференциального и интегрального исчисления
- •Основные правила дифференцирования
- •Основные правила интегрирования Неопределенный интеграл:
- •Определенный интеграл:
- •4. Критические значения коэффициента Стьюдента t
- •6. Стандартные энтальпии плавления и испарения при температуре фазового перехода
- •7. Константы Генри (Па) при 25с
- •8. Криоскопические и эбуллиоскопические константы
- •9. Термодинамические свойства простых веществ, ионов и соединений
- •Простые вещества и ионы
- •Неорганические соединения
- •Органические соединения Углеводороды
- •Кислородсодержащие соединения
- •Галогенсодержащие соединения
- •Азотсодержащие соединения
- •10. Теплота сгорания питательных веществ в живом организме и в калориметре
- •11. Криоскопические и эбуллиоскопические константы
- •12. Удельная электрическая проводимость растворов kCl
- •13. Предельные молярные подвижности ионов в водном растворе при 25°с
- •14. Молярная электропроводность разбавленных водных растворов электролитов при 25°с
- •15. Константы диссоциации слабых кислот при 25°с
- •16. Константы диссоциации слабых оснований при 25°с
- •17. Стандартные электродные потенциалы при 25°с
- •18. Основные физические постоянные
- •19. Плотность пав в жидком состоянии
- •20. Зависимость поверхностного натяжения воды от температуры
- •Литература
1.8.1. Термодинамика поверхностного слоя Основные уравнения Поверхностная энергия Гиббса и поверхностное натяжение
Поверхности раздела фаз (межфазные границы) могут существовать только при наличии в системе жидкой или твердой фазы. Межфазные границы являются сложными и своеобразными объектами. Главная их особенность определяется тем, что на очень малых расстояниях вглубь от межфазной поверхности (в пределах нескольких молекулярных размеров) физические и химические свойства вещества существенно отличаются от аналогичных свойств макроскопической (объемной) фазы того же вещества. Эта переходная область от одной фазы к другой, прилегающая к поверхности раздела фаз, называется поверхностным слоем. С физической и химической точки зрения поверхность раздела фаз не является чисто геометрическим объектом (плоскостью «нулевой» толщины), она представляет тонкий поверхностный слой малой, но конечной толщины δ>0.
Поверхностный слой жидкости вследствие подвижности молекул в объеме, а также в результате постоянно протекающих процессов испарения и конденсации находится в состоянии непрерывного обновления. Так, среднее время жизни молекулы воды на поверхности составляет около 10–7 с. Плотность граничного слоя между водной фазой и ее насыщенным паром изменяется непрерывно от плотности жидкой воды до плотности ее пара.
Энергетическое
состояние молекул вещества в объеме
фазы и в поверхностном слое не одинаково.
Например, на границе газ – жидкость
молекулы жидкости (рис. 61, молекула 1)
более слабо взаимодействуют с такими
же молекулами в газовой фазе, чем с
молекулами в жидкой. Это связано с
большими межмолекулярными расстояниями
в газовой фазе (рис. 61, молекулы 3 и
4) по сравнению с жидкой (рис. 61,
молекулы 5 и 6). Такое различие
приводит к неполной компенсации
межмолекулярных сил, действующих на
молекулу в поверхностном слое (рис. 61,
молекула 1) и к появлению силы, которая
стремится втянуть эту молекулу в объем
жидкой фазы. Для молекулы в объеме жидкой
фазы (рис. 61, молекула 2) равнодействующая
всех межмолекулярных взаимодействий
равна нулю. Следовательно, для выведения
молекул из объема жидкой фазы на
поверхность надо преодолеть эту силу,
то есть совершить работу и сообщить
молекулам некоторую избыточную
энергию, которую называют поверхностной
избыточной энергией Гиббса (![]() ).
).
Если увеличение площади поверхности границы раздела фаз производится при постоянных давлении и температуре (изобарно-изотермический процесс) и неизменных числах молей компонентов, то оно сопровождается увеличением поверхностной энергии системы (энергии Гиббса):
|
(292) |
где – удельная свободная поверхностная энергия, коэффициент поверхностного натяжения; dS – бесконечно малое изменение поверхности. Из уравнения (292) следует
|
(293) |
Таким образом, поверхностное натяжение можно представить как частную производную поверхностной избыточной энергией Гиббса по величине межфазной поверхности при р = const, Т = const и постоянных числах молей компонентов.
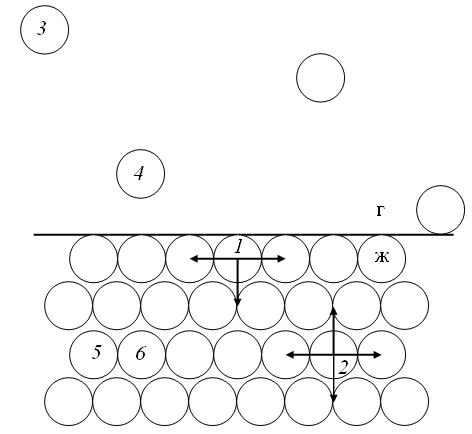
Рис. 61. Межмолекулярные взаимодействия в жидкой и газообразной фазах
Силы притяжения, втягивают молекулы жидкости с поверхности в глубь объема, уменьшая площадь поверхности до минимально возможной при данных условиях. Этим объясняется шарообразная форма мелких капель жидкости, находящихся в свободном состоянии в аэрозолях, туманах, эмульсиях.
В коллоидных высокодисперсных системах удельная поверхность, приходящаяся на единицу массы вещества, и поверхностная энергия Гиббса чрезвычайно велики. Поэтому почти все явления, изучаемые в коллоидной химии, так или иначе, связаны с большой удельной поверхностной энергией Гиббса.
