
- •Часть I
- •Содержание
- •Введение
- •Вводный блок основы математической обработки экспериментальных данных
- •1. Элементы теории вероятности и математической статистики
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •2. Ошибки измерений
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •3. Округление чисел
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •4. Построение графиков
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •5. Расчет коэффициентов прямой
- •Задачи и упражнения для самостоятельного решения
- •6. Линеаризация
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •7. Нахождение производных и интегрирование
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •1. Физическая химия модуль 1 термодинамика. Термохимия
- •1.1. Основные понятия и законы термодинамики. Термохимия
- •1.1.1. Первое начало термодинамики Основные уравнения
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •1.1.2. Термохимия Основные уравнения
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •1.1.3. Второе начало термодинамики. Энтропия Основные уравнения
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •1.1.4. Термодинамические потенциалы. Функции Гиббса, Гельмгольца Основные уравнения
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •1.2. Термодинамика химического равновесия
- •1.2.1. Изотерма химической реакции. Расчет констант равновесия химических реакций по термодинамическим таблицам Основные уравнения
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •1.2.2. Зависимость констант равновесия реакций от температуры. Расчет равновесного выхода продуктов реакции Основные уравнения
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •Модуль 2 химическое равновесие. Фазовые равновесия
- •1.3. Термодинамика фазовых равновесий
- •1.3.1. Фазовые равновесия в однокомпонентных системах. Правило фаз Гиббса. Уравнения Клапейрона, Клапейрона – Клаузиуса Основные уравнения
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •1.3.2. Фазовые равновесия в двухкомпонентных системах, перегонка Основные уравнения
- •Равновесие «твердое вещество – жидкость». Фазовая диаграмма системы с простой эвтектикой
- •Системы с ограниченной растворимостью в жидкой фазе (расслаивающиеся жидкости)
- •Перегонка с водяным паром
- •1.3.3. Фазовые равновесия в трехкомпонентных системах. Экстракция
- •П римеры решения типовых задач
- •Задачи для самостоятельного решения
- •Модуль 3 коллигативные свойства растворов. Электрохимия
- •1.4. Термодинамика разбавленных растворов, взаимосвязь между коллигативными свойствами
- •1.4.1. Давление пара растворителя над разбавленными растворами. Закон Рауля Основные уравнения
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.4.2. Осмотическое давление растворов Основные уравнения
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.4.3. Криоскопия. Эбуллиоскопия Основные уравнения Криоскопия
- •Эбулиоскопия
- •Экспериментальные методы определения молярных масс и изотонического коэффициента методом эбуллиоскопии и криоскопии
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.5. Термодинамика растворов электролитов
- •1.5.1. Теория растворов сильных электролитов Дебая – Хюккеля Основные уравнения
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.5.2. Буферные системы и растворы Основные уравнения
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.6. Электрохимия
- •1.6.1. Электропроводность растворов электролитов Основные уравнения
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.6.2. Электродные потенциалы и электродвижущие силы гальванических элементов
- •1.6.2.1. Электроды и электродные потенциалы Основные уравнения
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.6.2.2. Гальванические элементы и эдс Основные уравнения
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Модуль 4 кинетика химических реакций и катализ
- •1.7. Кинетика химических реакций
- •1.7.1. Скорость реакции Основные уравнения Скорость реакции
- •Расчет скорости реакции по экспериментальным данным, заданным в виде таблицы
- •Расчет скорости реакции по экспериментальным данным, заданным в виде графика
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.7.2. Формальная кинетика необратимых реакций нулевого, первого, второго порядков Основные уравнения Основной постулат химической кинетики – закон действия масс для кинетики
- •Молекулярность химической реакции
- •Реакция нулевого порядка
- •Реакция первого порядка
- •Реакция второго порядка
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Графический метод
- •Определение порядка реакции по периоду полупревращения
- •Дифференциальные методы Метод Вант-Гоффа
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.7.4. Зависимость скорости реакции от температуры Основные уравнения Правило Вант-Гоффа
- •Уравнение Аррениуса
- •Метод ускоренного определения срока годности лекарственных препаратов
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.7.5. Сложные реакции
- •Обратимые реакции
- •Параллельные реакции
- •Последовательные реакции
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •1.7.6. Ферментативный катализ
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Модуль 5 поверхностные явления и адсорбция
- •1.8. Поверхностные явления и адсорбция
- •1.8.1. Термодинамика поверхностного слоя Основные уравнения Поверхностная энергия Гиббса и поверхностное натяжение
- •Методы определения поверхностного натяжения на легкоподвижных границах фаз
- •Краевой угол смачивания
- •Зависимость поверхностного натяжения от температуры. Связь поверхностной энергии Гиббса и поверхностной энтальпии
- •Энтальпия смачивания и коэффициент гидрофильности
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.8.2. Адсорбция на границе «жидкость – газ» Основные уравнения Уравнение изотермы адсорбции Гиббса
- •Изотерма поверхностного натяжения
- •Поверхностно-активные, поверхностно-инактивные вещества, их молекулярное строение
- •Ориентация молекул в поверхностном слое
- •Адсорбция на границе «жидкость – газ». Уравнение Ленгмюра
- •Определение площади, занимаемой молекулой поверхностно-активного вещества в насыщенном адсорбционном слое, и максимальной длины молекулы пав
- •Уравнение Шишковского
- •Правило Дюкло – Траубе
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.8.3. Адсорбция на границе «твердое тело – газ» и «твердое тело – жидкость» Основные уравнения Мономолекулярная адсорбция, уравнение изотермы адсорбции Лэнгмюра, Фрейндлиха
- •Полимолекулярная адсорбция
- •Капиллярная конденсация
- •Адсорбция электролитов. Неспецифическая (эквивалентная) адсорбция ионов. Избирательная адсорбция ионов. Правило Панета – Фаянса
- •Ионный обмен. Иониты и их классификация. Обменная емкость. Применение ионитов в фармации
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Предметный указатель
- •Приложение
- •1. Основные единицы измерения физических величин
- •2. Основные физические постоянные
- •3. Основные математические формулы дифференциального и интегрального исчисления
- •Основные правила дифференцирования
- •Основные правила интегрирования Неопределенный интеграл:
- •Определенный интеграл:
- •4. Критические значения коэффициента Стьюдента t
- •6. Стандартные энтальпии плавления и испарения при температуре фазового перехода
- •7. Константы Генри (Па) при 25с
- •8. Криоскопические и эбуллиоскопические константы
- •9. Термодинамические свойства простых веществ, ионов и соединений
- •Простые вещества и ионы
- •Неорганические соединения
- •Органические соединения Углеводороды
- •Кислородсодержащие соединения
- •Галогенсодержащие соединения
- •Азотсодержащие соединения
- •10. Теплота сгорания питательных веществ в живом организме и в калориметре
- •11. Криоскопические и эбуллиоскопические константы
- •12. Удельная электрическая проводимость растворов kCl
- •13. Предельные молярные подвижности ионов в водном растворе при 25°с
- •14. Молярная электропроводность разбавленных водных растворов электролитов при 25°с
- •15. Константы диссоциации слабых кислот при 25°с
- •16. Константы диссоциации слабых оснований при 25°с
- •17. Стандартные электродные потенциалы при 25°с
- •18. Основные физические постоянные
- •19. Плотность пав в жидком состоянии
- •20. Зависимость поверхностного натяжения воды от температуры
- •Литература
1.7.4. Зависимость скорости реакции от температуры Основные уравнения Правило Вант-Гоффа
Приближенно зависимость константы скорости от температуры выражает правило Вант-Гоффа, согласно которому повышение температуры на 10°С (или, что то же самое, на 10 К) увеличивает константу скорости реакции в 2–4 раза:
|
(274) |
где k1 и k2 – константы скорости химической реакции при температурах T1 и T2; – температурный коэффициент скорости реакции, обычно равный 2–4.
При T2
–T1 = 10:
![]()
Это правило применимо для реакций, протекающих с небольшой скоростью при комнатных условиях, и не выполняется в широких температурных диапазонах и при высоких температурах, когда температурный коэффициент скорости становится переменной величиной.
Уравнение Аррениуса
Более точную зависимость константы скорости реакции от температуры выражает уравнение Аррениуса:
|
(275) |
или после логарифмирования
|
(276) |
где k – константа скорости химической реакции; А – предэкспоненциальный множитель; Eа – энергия активации реакции.
Величины А и Eа находят по графику в координатах "lnk – 1/T"

Угловой коэффициент прямой равен – Eа/R, а ордината точки пересечения прямой с вертикальной линией, проведенной через точку 1/Т = 0 на оси абсцисс, равна lnA.
Если известны значения константы скорости при двух температурах, то энергию активации реакции можно рассчитать по уравнению:
|
(277) |
Если известно значение константы скорости при некоторой температуре и энергия активации химической реакции, то значение константы скорости при другой температуре можно рассчитать по уравнению:
|
(278) |
Метод ускоренного определения срока годности лекарственных препаратов
Для ускоренного определения срока годности лекарственного препарата при обычной (25С) температуре необходимо определить срок годности при хранении этого препарата при повышенной (обычно на 15 К) температуре, порядок по лекарственному веществу реакции, приводящей к потере лекарственного вещества в лекарственном препарате, и энергию активации этой реакции.
Пусть известно, что порядок реакции по какому-то лекарственному веществу равен 1. Пусть срок годности – это интервал времени, в течение которого количество (концентрация) лекарственного вещества в лекарственном препарате уменьшается на 10%.
Тогда, например, срок годности при температуре 25С равен
![]()
Срок годности при хранении при повышенной температуре 40С равен
![]() .
.
Отношение сроков годности при двух температурах равно:
![]() .
.
Отношение констант скорости найдем из уравнения Аррениуса:
![]()
Подставляя отношение констант скорости в предыдущее уравнение, получим
|
(279) |
Примеры решения задач
1. Используя правило Вант-Гоффа, рассчитать на сколько нужно повысить температуру, чтобы скорость реакции возросла в 80,0 раз, если температурный коэффициент скорости реакции равен 3,00.
Решение:
Для расчета применим уравнение Вант-Гоффа (274)
после логарифмирования получим
![]()
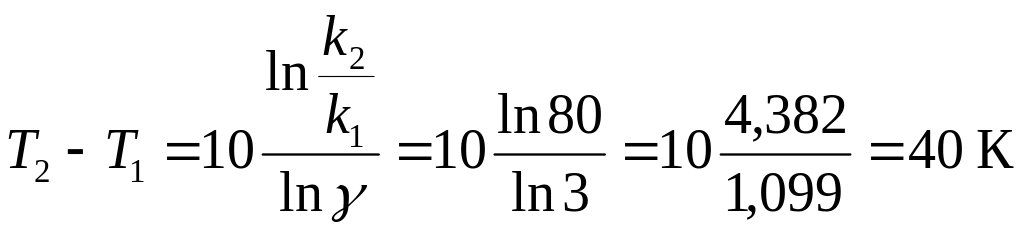
2. Для некоторой реакции константа скорости равна 0,006700 с–1 при температуре 443С и 0,06857 с–1 при температуре 497С. Найти константу скорости реакции при температуре 508С.
Решение:
Определим энергию активации реакции по уравнению (277)
или

![]()
![]()
![]()
Константу скорости при температуре 508С рассчитаем по уравнению (278)
![]()
![]()
![]()
![]()
3. При исследовании кинетики реакции взаимодействия иодистого метила с пиридином в тетрахлорэтане
C5H5N + CH3I [C5H5NCH3]+I–
были получены следующие данные
T, К |
293,1 |
303,1 |
313,1 |
323,3 |
k102, м3/(мольмин) |
0,713 |
1,50 |
3,50 |
5,89 |
Вычислить энергию активации графическим методом.
Решение:
Для расчета энергии активации реакции рассчитаем 1/T и ln k.
T, К |
293,1 |
303,1 |
313,1 |
323,3 |
k102, м3/(мольмин) |
0,713 |
1,50 |
3,50 |
5,89 |
1/T, 1/К |
0,003412 |
0,003299 |
0,003194 |
0,003093 |
ln [k102, м3/(мольмин)] |
– 0,338 |
0,405 |
1,253 |
1,773 |
Построим график зависимости в координатах "ln k – 1/T".

Рассчитаем коэффициенты уравнения (276) прямой
ln k = – 6772,4/T + 22,78
и энергию активации
![]()
![]()
4. Для ускоренного определения срока годности лекарственного препарата были проведены эксперименты при повышенной температуре 40С. В предварительных экспериментах было обнаружено, что реакция разложения лекарственного вещества подчиняется кинетике 1-го порядка. Энергия активации равна 39,7 кДж/моль. Обнаружено, что срок годности при этой температуре (время за которое разлагается 10% исходного вещества) равен 225 сут. Рассчитать срок годности при хранении лекарственного препарата при температуре 25С и тех же прочих условиях.
Решение:
Воспользуемся для расчета срока годности при нормальной температуре хранения (25С) уравнением (279).
![]()
![]()
![]()
![]()

 ,
,