
- •Часть I
- •Содержание
- •Введение
- •Вводный блок основы математической обработки экспериментальных данных
- •1. Элементы теории вероятности и математической статистики
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •2. Ошибки измерений
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •3. Округление чисел
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •4. Построение графиков
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •5. Расчет коэффициентов прямой
- •Задачи и упражнения для самостоятельного решения
- •6. Линеаризация
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •7. Нахождение производных и интегрирование
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •1. Физическая химия модуль 1 термодинамика. Термохимия
- •1.1. Основные понятия и законы термодинамики. Термохимия
- •1.1.1. Первое начало термодинамики Основные уравнения
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •1.1.2. Термохимия Основные уравнения
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •1.1.3. Второе начало термодинамики. Энтропия Основные уравнения
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •1.1.4. Термодинамические потенциалы. Функции Гиббса, Гельмгольца Основные уравнения
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •1.2. Термодинамика химического равновесия
- •1.2.1. Изотерма химической реакции. Расчет констант равновесия химических реакций по термодинамическим таблицам Основные уравнения
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •1.2.2. Зависимость констант равновесия реакций от температуры. Расчет равновесного выхода продуктов реакции Основные уравнения
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •Модуль 2 химическое равновесие. Фазовые равновесия
- •1.3. Термодинамика фазовых равновесий
- •1.3.1. Фазовые равновесия в однокомпонентных системах. Правило фаз Гиббса. Уравнения Клапейрона, Клапейрона – Клаузиуса Основные уравнения
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •1.3.2. Фазовые равновесия в двухкомпонентных системах, перегонка Основные уравнения
- •Равновесие «твердое вещество – жидкость». Фазовая диаграмма системы с простой эвтектикой
- •Системы с ограниченной растворимостью в жидкой фазе (расслаивающиеся жидкости)
- •Перегонка с водяным паром
- •1.3.3. Фазовые равновесия в трехкомпонентных системах. Экстракция
- •П римеры решения типовых задач
- •Задачи для самостоятельного решения
- •Модуль 3 коллигативные свойства растворов. Электрохимия
- •1.4. Термодинамика разбавленных растворов, взаимосвязь между коллигативными свойствами
- •1.4.1. Давление пара растворителя над разбавленными растворами. Закон Рауля Основные уравнения
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.4.2. Осмотическое давление растворов Основные уравнения
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.4.3. Криоскопия. Эбуллиоскопия Основные уравнения Криоскопия
- •Эбулиоскопия
- •Экспериментальные методы определения молярных масс и изотонического коэффициента методом эбуллиоскопии и криоскопии
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.5. Термодинамика растворов электролитов
- •1.5.1. Теория растворов сильных электролитов Дебая – Хюккеля Основные уравнения
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.5.2. Буферные системы и растворы Основные уравнения
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.6. Электрохимия
- •1.6.1. Электропроводность растворов электролитов Основные уравнения
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.6.2. Электродные потенциалы и электродвижущие силы гальванических элементов
- •1.6.2.1. Электроды и электродные потенциалы Основные уравнения
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.6.2.2. Гальванические элементы и эдс Основные уравнения
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Модуль 4 кинетика химических реакций и катализ
- •1.7. Кинетика химических реакций
- •1.7.1. Скорость реакции Основные уравнения Скорость реакции
- •Расчет скорости реакции по экспериментальным данным, заданным в виде таблицы
- •Расчет скорости реакции по экспериментальным данным, заданным в виде графика
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.7.2. Формальная кинетика необратимых реакций нулевого, первого, второго порядков Основные уравнения Основной постулат химической кинетики – закон действия масс для кинетики
- •Молекулярность химической реакции
- •Реакция нулевого порядка
- •Реакция первого порядка
- •Реакция второго порядка
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Графический метод
- •Определение порядка реакции по периоду полупревращения
- •Дифференциальные методы Метод Вант-Гоффа
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.7.4. Зависимость скорости реакции от температуры Основные уравнения Правило Вант-Гоффа
- •Уравнение Аррениуса
- •Метод ускоренного определения срока годности лекарственных препаратов
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.7.5. Сложные реакции
- •Обратимые реакции
- •Параллельные реакции
- •Последовательные реакции
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •1.7.6. Ферментативный катализ
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Модуль 5 поверхностные явления и адсорбция
- •1.8. Поверхностные явления и адсорбция
- •1.8.1. Термодинамика поверхностного слоя Основные уравнения Поверхностная энергия Гиббса и поверхностное натяжение
- •Методы определения поверхностного натяжения на легкоподвижных границах фаз
- •Краевой угол смачивания
- •Зависимость поверхностного натяжения от температуры. Связь поверхностной энергии Гиббса и поверхностной энтальпии
- •Энтальпия смачивания и коэффициент гидрофильности
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.8.2. Адсорбция на границе «жидкость – газ» Основные уравнения Уравнение изотермы адсорбции Гиббса
- •Изотерма поверхностного натяжения
- •Поверхностно-активные, поверхностно-инактивные вещества, их молекулярное строение
- •Ориентация молекул в поверхностном слое
- •Адсорбция на границе «жидкость – газ». Уравнение Ленгмюра
- •Определение площади, занимаемой молекулой поверхностно-активного вещества в насыщенном адсорбционном слое, и максимальной длины молекулы пав
- •Уравнение Шишковского
- •Правило Дюкло – Траубе
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.8.3. Адсорбция на границе «твердое тело – газ» и «твердое тело – жидкость» Основные уравнения Мономолекулярная адсорбция, уравнение изотермы адсорбции Лэнгмюра, Фрейндлиха
- •Полимолекулярная адсорбция
- •Капиллярная конденсация
- •Адсорбция электролитов. Неспецифическая (эквивалентная) адсорбция ионов. Избирательная адсорбция ионов. Правило Панета – Фаянса
- •Ионный обмен. Иониты и их классификация. Обменная емкость. Применение ионитов в фармации
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Предметный указатель
- •Приложение
- •1. Основные единицы измерения физических величин
- •2. Основные физические постоянные
- •3. Основные математические формулы дифференциального и интегрального исчисления
- •Основные правила дифференцирования
- •Основные правила интегрирования Неопределенный интеграл:
- •Определенный интеграл:
- •4. Критические значения коэффициента Стьюдента t
- •6. Стандартные энтальпии плавления и испарения при температуре фазового перехода
- •7. Константы Генри (Па) при 25с
- •8. Криоскопические и эбуллиоскопические константы
- •9. Термодинамические свойства простых веществ, ионов и соединений
- •Простые вещества и ионы
- •Неорганические соединения
- •Органические соединения Углеводороды
- •Кислородсодержащие соединения
- •Галогенсодержащие соединения
- •Азотсодержащие соединения
- •10. Теплота сгорания питательных веществ в живом организме и в калориметре
- •11. Криоскопические и эбуллиоскопические константы
- •12. Удельная электрическая проводимость растворов kCl
- •13. Предельные молярные подвижности ионов в водном растворе при 25°с
- •14. Молярная электропроводность разбавленных водных растворов электролитов при 25°с
- •15. Константы диссоциации слабых кислот при 25°с
- •16. Константы диссоциации слабых оснований при 25°с
- •17. Стандартные электродные потенциалы при 25°с
- •18. Основные физические постоянные
- •19. Плотность пав в жидком состоянии
- •20. Зависимость поверхностного натяжения воды от температуры
- •Литература
Равновесие «твердое вещество – жидкость». Фазовая диаграмма системы с простой эвтектикой
Равновесия в системах «твердое вещество – жидкость» встречаются при изучении различных металлических сплавов, силикатов, водных растворов солей, систем, состоящих из органических соединений.
Особое значение имеют исследования зависимостей температур начала и конца кристаллизации твердых веществ от состава системы. Графики, выражающие эту зависимость, называются фазовыми диаграммами или диаграммами плавкости.
Диаграммы плавкости строятся на основании результатов термического анализа, который заключается в наблюдении за скоростью охлаждения расплавленных чистых веществ и их смесей.
Диаграммы такого типа отвечают бинарным системам, в которых вещества неограниченно смешиваются в жидком состоянии, образуя гомогенный раствор и практически не растворяются в твердом состоянии, образуя гетерогенную систему из твердых фаз.
Рассмотрим построение и анализ такой диаграммы на примере системы из веществ А и В.
I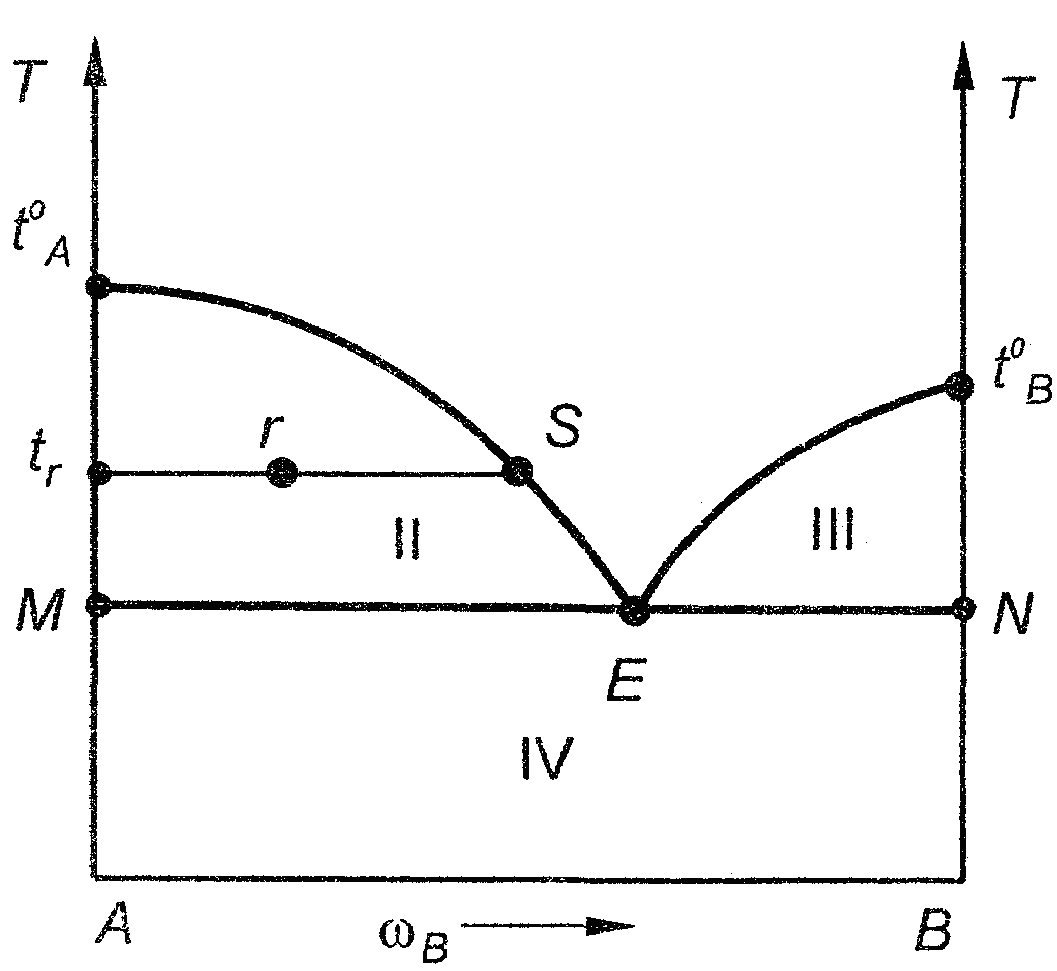
Рис. 41. Фазовая диаграмма системы
с простой эвтектикой
Линия
![]() – линия ликвидуса, линия MN
– линия солидуса, они разбивают диаграмму
на четыре области:
– линия ликвидуса, линия MN
– линия солидуса, они разбивают диаграмму
на четыре области:
область I –жидкий расплав;
область II – гетерогенная система, состоящая из кристаллов вещества А и жидкого расплава переменного состава;
область III – гетерогенная система, состоящая из кристаллов вещества В и жидкого расплава переменного состава;
область IV – гетерогенная система, состоящая из смеси кристаллов А и В.
Каждая точка на диаграмме называется фигуративной и соответствует одному строго определенному состоянию системы в зависимости от того, где эта точка лежит.
Чтобы найти состав сосуществующих фаз, надо через фигуративную точку провести горизонталь до пересечения с граничными линиями, из точки пересечения с одной граничной линией опустить перпендикуляр на ось состава – это даст состав одной фазы, из другой – состав другой фазы. Например, для того чтобы найти состав сосуществующих фаз в точке r, проведем горизонталь до пересечения с линией ликвидус и опустим перпендикуляр из точки пересечения (S), определим массовую долю В в расплаве (ωВ), второй конец горизонтали пересекается с левой осью ординат, соответствующей чистому веществу А, находящемуся при температуре tr, ниже температуры его плавления (t0А), следовательно вещество А находится в виде кристаллов.
Диаграмма плавкости позволяет определить не только число фаз и их состав, но и относительные массы фаз, с помощью правила рычага:
|
(147) |
где gж – масса расплава, г; gтв – масса кристаллов, г.
Отрезки trr и rS измеряются на диаграмме в сантиметрах или миллиметрах (рис. 41).
Одним из методов построения диаграмм состояния является метод термического анализа, который заключается в построении кривых охлаждения. Рассмотрим пример: расплавим чистое вещество А и будем его равномерно охлаждать, измеряя температуру. Нанеся эти данные на график, получим кривую охлаждения (рис. 42). Кривая охлаждения любого чистого вещества (однокомпонентная система K = 1) будет состоять из трех участков ab, bc, cd.
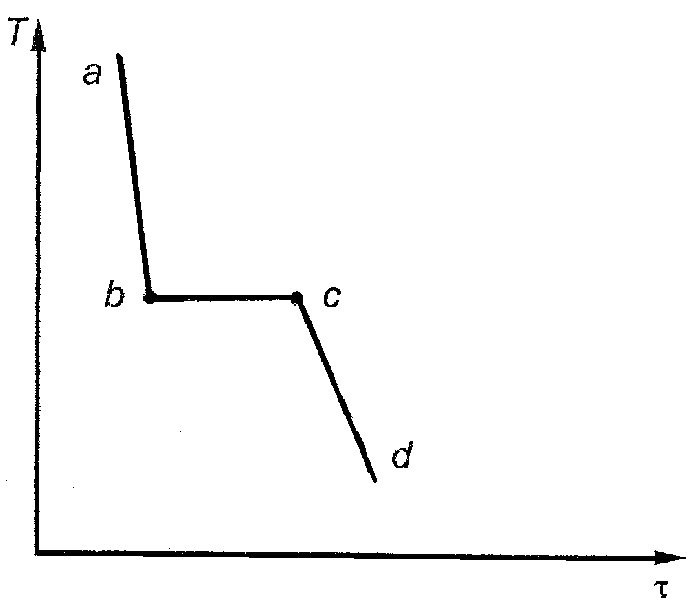
Рис. 42. Кривая охлаждения чистого вещества
Изломы на кривых охлаждения (графиках в координатах «температура – время») свидетельствуют об изменении числа фаз в системе (рис. 42 и 43).
Участок ab соответствует охлаждению чистого жидкого вещества А, так как охлаждение ведется равномерно, то он соответствует прямой линии, наклоненной под определенным углом. Число степеней свободы (С) в такой системе рассчитываем по правилу фаз Гиббса: С = K – Ф + n; n = 1, а С = 1 – 1 + 1 = 1 (то есть температура понижается, но при этом сохраняется жидкая фаза).
Когда в жидкости появятся первые кристаллы, система станет двухфазной (твердая и жидкая фазы), а число степеней свободы становится равным нулю: С = 1 – 2 + 1 = 0. Следовательно, при охлаждении однокомпонентной системы (чистого вещества) температура не может изменяться, на кривой охлаждения появляется горизонтальный участок – участок bc.
Охлаждение системы компенсируется теплотой, которая выделяется при кристаллизации. Таким образом, температура горизонтального участка – это температура кристаллизации чистого вещества А.
Когда вся жидкость закристаллизуется, в системе останется одна фаза – твердая, число степеней свободы снова станет равно 1: С = 1 – 1 + 1 = 1.
Такая же кривая охлаждения соответствует и чистому веществу В, только горизонтальный участок будет наблюдаться при другой температуре (при температуре плавления В).
Теперь к твердому веществу А добавим 10% вещества В, смесь расплавим, получим расплав и будем его охлаждать. По результатам охлаждения построим кривую охлаждения (рис. 43), она состоит из четырех участков: mn, nf, fk и kl.
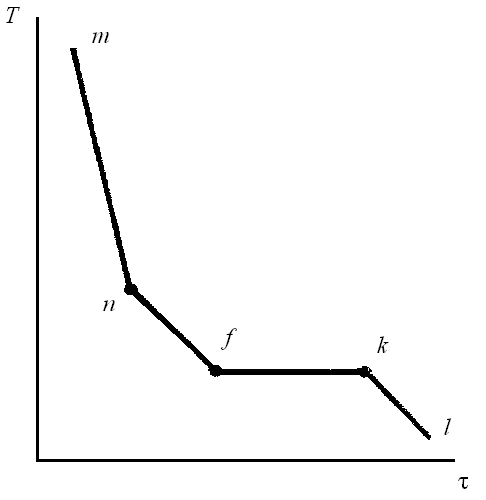
Рис. 43. Кривая охлаждения смеси
Участок mn соответствует охлаждению расплава:
С = 2 – 1 + 1 = 2.
Как только в расплаве появятся кристаллы вещества А (С = 2 – 2 + 1 = 1), температура системы будет понижаться уже медленнее из-за того, что при образовании кристаллов выделяется теплота, замедляющая охлаждение, на кривой появится изгиб (точка n), который будет указывать температуру начала кристаллизации (Tn). В соответствии с законом Рауля наблюдается понижение температуры замерзания раствора (температура начала выпадения кристаллов) по сравнению с температурой замерзания чистого жидкого вещества, поэтому Tn < TА. Следовательно, участок nf относится к охлаждению системы, состоящей из расплава и кристаллов вещества А.
При температуре Tk в системе появляются и кристаллы вещества В. Так как в твердом состоянии вещества A и В совершенно не растворяются друг в друге, а выделяются в виде самостоятельных твердых фаз, то Ф = 3 (две твердые фазы и жидкая). С = 2 – 3 + 1 = 0.
Температура остается постоянной, на кривой охлаждения наблюдается горизонтальный участок fk, температура, которая ему соответствует (Tk) – это температура конца кристаллизации 10% расплава вещества В.
После окончания кристаллизации (жидкая фаза исчезает), Ф = 2 (кристаллы А и кристаллы В), наблюдается охлаждение гетерогенной твердой системы (участок kl): С = 2 – 2 + 1 = 1.
Вид кривых охлаждения для расплавов других концентраций такой же, только перегиб появляется при строго определенной температуре (т.е. температура начала кристаллизации Tn для расплава индивидуальна). Но конец кристаллизации (горизонтальный участок) для расплавов всех концентраций отвечает одной и той же температуре Tk, ее называют температурой эвтектики.
Таким образом, каждая кривая охлаждения дает возможность определить две температуры –начала и конца кристаллизации.
Если нанести эти температуры на график в координатах «T – состав» и соединить между собой все точки начала кристаллизации (линия ликвидуса) и все точки конца кристаллизации (линия солидуса), то получим диаграмму плавкости, общий вид которой представлен на рисунке 41.
