
- •Часть I
- •Содержание
- •Введение
- •Вводный блок основы математической обработки экспериментальных данных
- •1. Элементы теории вероятности и математической статистики
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •2. Ошибки измерений
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •3. Округление чисел
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •4. Построение графиков
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •5. Расчет коэффициентов прямой
- •Задачи и упражнения для самостоятельного решения
- •6. Линеаризация
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •7. Нахождение производных и интегрирование
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •1. Физическая химия модуль 1 термодинамика. Термохимия
- •1.1. Основные понятия и законы термодинамики. Термохимия
- •1.1.1. Первое начало термодинамики Основные уравнения
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •1.1.2. Термохимия Основные уравнения
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •1.1.3. Второе начало термодинамики. Энтропия Основные уравнения
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •1.1.4. Термодинамические потенциалы. Функции Гиббса, Гельмгольца Основные уравнения
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •1.2. Термодинамика химического равновесия
- •1.2.1. Изотерма химической реакции. Расчет констант равновесия химических реакций по термодинамическим таблицам Основные уравнения
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •1.2.2. Зависимость констант равновесия реакций от температуры. Расчет равновесного выхода продуктов реакции Основные уравнения
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •Модуль 2 химическое равновесие. Фазовые равновесия
- •1.3. Термодинамика фазовых равновесий
- •1.3.1. Фазовые равновесия в однокомпонентных системах. Правило фаз Гиббса. Уравнения Клапейрона, Клапейрона – Клаузиуса Основные уравнения
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •1.3.2. Фазовые равновесия в двухкомпонентных системах, перегонка Основные уравнения
- •Равновесие «твердое вещество – жидкость». Фазовая диаграмма системы с простой эвтектикой
- •Системы с ограниченной растворимостью в жидкой фазе (расслаивающиеся жидкости)
- •Перегонка с водяным паром
- •1.3.3. Фазовые равновесия в трехкомпонентных системах. Экстракция
- •П римеры решения типовых задач
- •Задачи для самостоятельного решения
- •Модуль 3 коллигативные свойства растворов. Электрохимия
- •1.4. Термодинамика разбавленных растворов, взаимосвязь между коллигативными свойствами
- •1.4.1. Давление пара растворителя над разбавленными растворами. Закон Рауля Основные уравнения
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.4.2. Осмотическое давление растворов Основные уравнения
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.4.3. Криоскопия. Эбуллиоскопия Основные уравнения Криоскопия
- •Эбулиоскопия
- •Экспериментальные методы определения молярных масс и изотонического коэффициента методом эбуллиоскопии и криоскопии
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.5. Термодинамика растворов электролитов
- •1.5.1. Теория растворов сильных электролитов Дебая – Хюккеля Основные уравнения
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.5.2. Буферные системы и растворы Основные уравнения
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.6. Электрохимия
- •1.6.1. Электропроводность растворов электролитов Основные уравнения
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.6.2. Электродные потенциалы и электродвижущие силы гальванических элементов
- •1.6.2.1. Электроды и электродные потенциалы Основные уравнения
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.6.2.2. Гальванические элементы и эдс Основные уравнения
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Модуль 4 кинетика химических реакций и катализ
- •1.7. Кинетика химических реакций
- •1.7.1. Скорость реакции Основные уравнения Скорость реакции
- •Расчет скорости реакции по экспериментальным данным, заданным в виде таблицы
- •Расчет скорости реакции по экспериментальным данным, заданным в виде графика
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.7.2. Формальная кинетика необратимых реакций нулевого, первого, второго порядков Основные уравнения Основной постулат химической кинетики – закон действия масс для кинетики
- •Молекулярность химической реакции
- •Реакция нулевого порядка
- •Реакция первого порядка
- •Реакция второго порядка
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Графический метод
- •Определение порядка реакции по периоду полупревращения
- •Дифференциальные методы Метод Вант-Гоффа
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.7.4. Зависимость скорости реакции от температуры Основные уравнения Правило Вант-Гоффа
- •Уравнение Аррениуса
- •Метод ускоренного определения срока годности лекарственных препаратов
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.7.5. Сложные реакции
- •Обратимые реакции
- •Параллельные реакции
- •Последовательные реакции
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •1.7.6. Ферментативный катализ
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Модуль 5 поверхностные явления и адсорбция
- •1.8. Поверхностные явления и адсорбция
- •1.8.1. Термодинамика поверхностного слоя Основные уравнения Поверхностная энергия Гиббса и поверхностное натяжение
- •Методы определения поверхностного натяжения на легкоподвижных границах фаз
- •Краевой угол смачивания
- •Зависимость поверхностного натяжения от температуры. Связь поверхностной энергии Гиббса и поверхностной энтальпии
- •Энтальпия смачивания и коэффициент гидрофильности
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.8.2. Адсорбция на границе «жидкость – газ» Основные уравнения Уравнение изотермы адсорбции Гиббса
- •Изотерма поверхностного натяжения
- •Поверхностно-активные, поверхностно-инактивные вещества, их молекулярное строение
- •Ориентация молекул в поверхностном слое
- •Адсорбция на границе «жидкость – газ». Уравнение Ленгмюра
- •Определение площади, занимаемой молекулой поверхностно-активного вещества в насыщенном адсорбционном слое, и максимальной длины молекулы пав
- •Уравнение Шишковского
- •Правило Дюкло – Траубе
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •1.8.3. Адсорбция на границе «твердое тело – газ» и «твердое тело – жидкость» Основные уравнения Мономолекулярная адсорбция, уравнение изотермы адсорбции Лэнгмюра, Фрейндлиха
- •Полимолекулярная адсорбция
- •Капиллярная конденсация
- •Адсорбция электролитов. Неспецифическая (эквивалентная) адсорбция ионов. Избирательная адсорбция ионов. Правило Панета – Фаянса
- •Ионный обмен. Иониты и их классификация. Обменная емкость. Применение ионитов в фармации
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Предметный указатель
- •Приложение
- •1. Основные единицы измерения физических величин
- •2. Основные физические постоянные
- •3. Основные математические формулы дифференциального и интегрального исчисления
- •Основные правила дифференцирования
- •Основные правила интегрирования Неопределенный интеграл:
- •Определенный интеграл:
- •4. Критические значения коэффициента Стьюдента t
- •6. Стандартные энтальпии плавления и испарения при температуре фазового перехода
- •7. Константы Генри (Па) при 25с
- •8. Криоскопические и эбуллиоскопические константы
- •9. Термодинамические свойства простых веществ, ионов и соединений
- •Простые вещества и ионы
- •Неорганические соединения
- •Органические соединения Углеводороды
- •Кислородсодержащие соединения
- •Галогенсодержащие соединения
- •Азотсодержащие соединения
- •10. Теплота сгорания питательных веществ в живом организме и в калориметре
- •11. Криоскопические и эбуллиоскопические константы
- •12. Удельная электрическая проводимость растворов kCl
- •13. Предельные молярные подвижности ионов в водном растворе при 25°с
- •14. Молярная электропроводность разбавленных водных растворов электролитов при 25°с
- •15. Константы диссоциации слабых кислот при 25°с
- •16. Константы диссоциации слабых оснований при 25°с
- •17. Стандартные электродные потенциалы при 25°с
- •18. Основные физические постоянные
- •19. Плотность пав в жидком состоянии
- •20. Зависимость поверхностного натяжения воды от температуры
- •Литература
Задачи для самостоятельного решения
1. Для реакции I2 (;( 2I приводятся константы равновесия при нескольких температурах:
Т, К |
950 |
1050 |
1150 |
1250 |
Kр103 |
1,134 |
7,316 |
33,83 |
127,1 |
Постройте график
зависимости
lnKр
от 1/Т
и определите
![]() реакции.
реакции.
(Ответ: 150,0 кДж)
2. Для реакции C6H6(г) + 3H2 (;( C6H12 (г) зависимость константы равновесия от температуры выражается уравнением
![]()
Выведите
уравнение зависимости
в этой реакции от температуры и рассчитайте
![]() .
.
(Ответ: –204,3 кДж)
3. Для реакции SO2 + 1/2O2 (;( SO3 константа равновесия Kр при 900 К равна 0,04310–2, а при 950 К – 1,06210–2. Определите Kр при 930 К. Примите, что тепловой эффект в температурном диапазоне 900 – 950 К постоянен.
(Ответ: Kp = 3,110–3)
4. Для реакции цис-C5H10(г) + 2H2 (;( C3H8(г) + C2H6(г) протекающей в газовой фазе, при температуре 750 К известна константа равновесия Kр = 3,343 атм–1. Рассчитайте выход продуктов, если давление равно 5 атм, исходное количество циклопентана равно 1,2 моль, а водорода – 2,4 моль.
(Ответ: 73,6%)
Модуль 2 химическое равновесие. Фазовые равновесия
1.3. Термодинамика фазовых равновесий
Раздел "Термодинамика фазовых равновесий" имеет непосредственное отношение к прогнозированию состояния индивидуальных лекарственных веществ и их смесей. Теория фазовых равновесий позволяет выявлять случаи физико-химической несовместимости фармацевтических препаратов. Термодинамические методы используются для теоретического описания и практических расчетов таких широко распространенных процессов разделения и очистки многокомпонентных смесей, как простая перегонка и ректификация, перегонка с водяным паром и экстракция. Закономерности, изучаемые в данном разделе, позволяют обоснованно выбирать оптимальные условия проведения перечисленных процессов, при которых достигается наилучшее качество фармацевтических препаратов.
1.3.1. Фазовые равновесия в однокомпонентных системах. Правило фаз Гиббса. Уравнения Клапейрона, Клапейрона – Клаузиуса Основные уравнения
Термодинамическая система – это тело или группа тел, находящихся во взаимодействии и условно обособленных от окружающей среды.
Система называется гомогенной, если она состоит из одной фазы. Система называется гетерогенной, если она состоит из двух или более фаз.
Фазой называется совокупность однородных частей системы (т.е. одинаковых по физическим, химическим и термодинамическим свойствам), отделенная от других частей системы физической (реально существующей) поверхностью раздела. Индивидуальное вещество в твердом агрегатном состоянии всегда образует самостоятельную фазу.
Жидкие и твердые фазы называются конденсированными.
Если вещество содержится одновременно в разных фазах, то происходит его переход из одной фазы в другую, такой переход называется фазовым. Состояние, при котором скорости противоположных фазовых переходов равны, называется фазовым равновесием.
Компонентами (составляющими веществами) называются все химические вещества, которые могут быть выделены из системы и существовать вне ее.
Число степеней свободы – это число интенсивных термодинамических параметров, которые можно произвольно менять в некоторых пределах, чтобы не изменилось число и природа фаз в системе.
Расчет числа C в равновесной системе в зависимости от числа компонентов K, числа фаз Ф и от числа термодинамических параметров n, которые отличаются от химических потенциалов, (в подсчете участвуют параметры р и Т) производят с помощью правила фаз Гиббса (1876):
С = K – Ф + n. |
(135) |
Если из внешних параметров на систему оказывают влияние p и T, то n = 2 и правило фаз принимает вид
С = K – Ф + 2 |
(136) |
Если из внешних параметров на систему оказывает влияние только температура, а давление постоянно (или наоборот), то правило фаз принимает вид
С = K – Ф + 1 |
(137) |
Для однокомпонентных систем, примером которых является система, образованная водой, как компонентом,
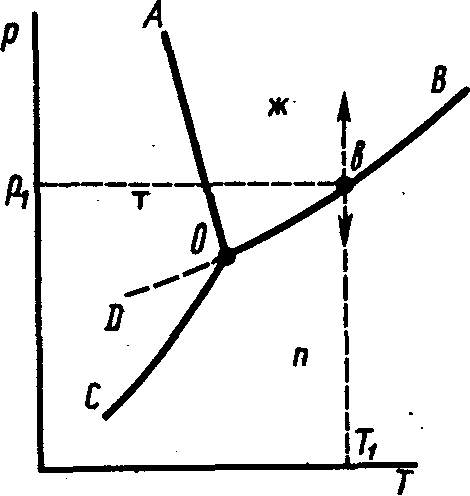
Рис. 40. Диаграмма состояния воды
правило фаз (135) принимает вид
С = 1 – Ф + 2 = 3 – Ф, |
(138) |
Если минимальное число степеней свободы (Сmin) равно нулю (система инвариантна), то, согласно (138), Ф = 3. В равновесной однокомпонентной системе могут сосуществовать максимально три фазы (т, ж, г). Максимальным числом степеней свободы (Сmax) система обладает при Фmin, которое не может быть меньше единицы. Следовательно, Сmax= 1 – 1 + 2 = 2. Этими степенями свободы являются давление и температура.
На диаграмме состояния воды имеются три поля: льда (т), жидкости (ж) и пара (п). В пределах каждого поля можно произвольно менять температуру и давление без изменения числа фаз, так как при Ф = 1 число степеней свободы
С = 1 – 1 + 2 = 2.
Кривые АО, ВО и СО характеризуют те значения р и Т, при которых в системе имеются в равновесии две фазы. Каждая из кривых показывает зависимость температуры фазового перехода от внешнего давления.
Система, заданная точкой на любой кривой, моновариантна, то есть имеет одну степень свободы (С = 3 – 2 = 1). Следовательно, произвольно можно изменять или давление, или температуру. Второй параметр изменяется в зависимости от первого. Например, при выбранной температуре T1 (рис. 40) равновесие ж (;( п может существовать только при давлении р1 (точка b). Если при Т1 произвольно изменить давление, то система из двухфазной перейдет в однофазную.
Точка О на диаграмме соответствует системе, в которой существуют три фазы (т, ж, п). В этом случае С = 1 – 3 + 2 = 0 (система инвариантна). В таком состоянии система может находиться при t = 0,0076 °С и давлении 610 Па. Точку О называют тройной точкой воды. Даже небольшое изменение одного из параметров нарушает равновесие и приводит к исчезновению одной или двух фаз.
Уравнение Клапейрона (1834) связывает между собой давление, при котором происходит фазовый переход, и температуру фазового перехода. Для процесса испарения воды в дифференциальной форме оно имеет вид
|
(139) |
или
|
(140) |
Позже оно было модифицировано Р.Клаузиусом (1836) для равновесий, в которых одна из фаз является паром: "жидкость" – "пар" и "твердая фаза" – "пар". В этом частном случае оно называется уравнением Клапейрона – Клаузиуса и в дифференциальной форме имеет вид
|
(141) |
или
|
(142) |
После перехода к интегральной форме уравнения Клапейрона – Клаузиуса оно позволяет рассчитывать значение давления, при котором устанавливается фазовое равновесие, в зависимости от температуры
|
(143) |
|
(144) |

