
- •Методические указания
- •Общие правила работы в химической лаборатории и техника безопасности. Оформление лабораторных работ
- •Рабочее место студента
- •Лабораторная работа № 1 общие правила работы в химических лабораториях. Классы химических соединений.
- •Лабораторная работа № 2 «определение карбонатной жесткости воды»
- •Теоретическое обоснование
- •Методика и выполнение работы:
- •Лабораторная работа № 3 «Получение, собирание и распознавание газов»
- •Лабораторная работа № 4 «скорость химических реакций»
- •Теоретическое обоснование
- •Лабораторная работа № 5 «растворы. Приготовление растворов заданной концентрации»
- •Теоретическое обоснование
- •Методика и выполнение работы:
- •Лабораторная работа № 6 «Химические свойства кислот»
- •Теоретическое обоснование
- •Методика и выполнение работы: Опыт №1 Взаимодействие кислот с металлами
- •Лабораторная работа № 7 «Реакции ионного обмена в растворах электролитов. Испытание растворов кислот, оснований и солей индикаторами»
- •Теоретическое обоснование
- •Методика и выполнение работы:
- •2.1. Смещение равновесия в ацетатных системах.
- •2.2. Смещение равновесия в растворе гидроксида аммония
- •Лабораторная работа № 8 «Получение и свойства нерастворимых оснований.
- •Теоретическое обоснование
- •Методика и выполнение работы: Опыт 1. Получение гидроксида алюминия и исследование его свойств
- •Опыт 2. Получение гидроксида меди (II) и исследование его свойств
- •Опыт 3. Получение и свойства гидроксида цинка
- •Лабораторная работа № 9 «гидролиз. Факторы, влияющие на гидролиз солей»
- •Теоретическое обоснование
- •Методика и выполнение работы: Опыт 1. Гидролиз солей.
- •Опыт 2. Влияние природы соли на гидролиз
- •2.1. Гидролиз солей слабых кислот.
- •2.2. Гидролиз солей ортофосфорной кислоты
- •3.1. Влияние температуры на степень гидролиза гидрокарбоната натрия (питьевая сода)
- •3.2. Влияние температуры на степень гидролизапродуктов реакции хлорида железа (III) и ацетата натрия
- •Лабораторная работа № 10 «окислительно-восстановительные реакции»
- •Теоретическое обоснование
- •Основные положения теории окислительно-восстановительных реакций
- •Лабораторная работа № 11 «окислительно-восстановительные реакции: влияние кислотности среды»
- •Теоретическое обоснование
- •Лабораторная работа № 12 «коррозия металлов и методы защиты от коррозии»
- •Теоретическое обоснование
- •Методика выполнения работы:
- •Лабораторная работа № 13
- •Теоретическая часть
- •Опыт 2 Характерные качественные реакции анионов хлора , брома и йода
- •Опыт 3. Восстановительные свойства серы (делается под тягой)
- •Опыт 4. Гидролиз солей ортофосфорной кислоты
- •Опыт 5. Качественная реакция на фосфат-ион
- •Опыт 6. Получение азота (демонстрационный опыт)
- •Опыт 2. Окисление спирта хромовой смесью
- •Опыт 3. Получение глицерата меди
- •Опыт 4. Образование и гидролиз ацетата железа (III.)
- •Лабораторная работа № 16 «Получение этилена и исследование его свойств»
- •1. Химические свойства углеводов.
- •Опыт 2. Действие йода на крахмал
- •2. Получение и исследование химических свойств альдегидов и кетонов Методика и выполнение работы:
- •1.1 Качественная реакция на формальдегид с резорцином.
- •1.2 Реакция альдегидов и кетонов с нитропруссидом натрия
- •Опыт 2. Окисление формальдегида аммиачным раствором гидроксида серебра.
- •Опыт 2. Получение медной соли глицерина
- •Опыт 3. Денатурация белка
- •Опыт 4. Цветные реакции белков
- •Лабораторная работа № 19 «идентификация органических соединений»
- •Методика и выполнение работы
- •Приложение
- •Список рекомендуемой литературы
Лабораторная работа № 8 «Получение и свойства нерастворимых оснований.
Цель и содержание работы:
Ознакомиться со способами получения нерастворимых оснований; получить и исследовать их свойства; ознакомиться с явлением гидролиза солей и практическими следствиями этого явления; провести гидролиз хлоридов и ацетатов щелочных металлов.
Теоретическое обоснование
Основания – это сложные вещества, молекулы которых состоят из атомов металла и одной или нескольких гидроксильных групп (ОН). Общая формула оснований:
Me(OH)n,
где n – число гидроксильных групп, равное валентности металла.
Примеры оснований: NaOH, Ca(OH)2 , Co(OH)3 . Классификацию оснований проводят:
а) по числу гидроксильных групп в молекуле. Количество гидроксильных групп в молекуле основания зависит от валентности металла и определяет кислотность основания. По этому признаку основания делятся на однокислотные (NaOH, LiOH, KOH и др.), двукислотные (Ca(OH)2, Fe(OH)2 и др.) и т.д. Двух- и трёхкислотные основания называются многокислотными.
б) по растворимости в воде основания делятся на:
− растворимые ( LiOH, NaOH, CsOH, Ca(OH)2, Ba(OH)2 );
− нерастворимые (Cu(OH)2 , Fe(OH)2 , Fe(OH)3и др.).
Растворимые в воде основания называются щелочами.
Среди оснований выделяют также амфотерные гидроксиды – сложные вещества, которые имеют свойства кислот и свойства оснований. Например,
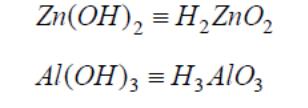
Для удобства амфотерным гидроксидам можно придать форму либо кислоты, либо основания, например, Zn(OH)2 и H2ZnO2, AlOOH и HAlO2. Традиционно их называют и как кислоты, и как основания: AlOOH – гидроксид оксоалюминия или метаалюминиевая кислота; Al(OH)3 или H3AlO3 − тригидроксид алюминия или ортоалюминиевая кислота.
Графическое изображение амфотерных оксидов строятся по аналогии с
основными гидроксидами и кислотами:
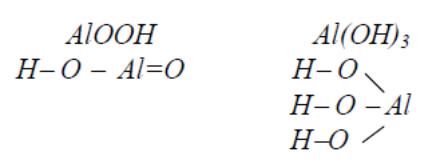
Аппаратура и материалы:
Пробирки; штатив для пробирок; раствор AlCl3; раствор CuSO4; раствор ZnCl2; раствор соляной кислоты HCl (разбавленный); фильтр; раствор гидроксида натрия NaOH; держатель; спиртовка; чашечка для выпаривания.
Методика и выполнение работы: Опыт 1. Получение гидроксида алюминия и исследование его свойств
1. В пробирку внесите 1 – 2 мл раствора AlCl3 и прибавьте по каплям раствор NaOH до выпадения осадка. Отметьте цвет осадка. Запишите уравнения получения гидроксида алюминия.
2. Проверьте растворимость гидроксида алюминия в кислоте и избытке щелочи, для чего образовавшийся студенистый осадок разделите на две пробирки. К первой прилейте 1 – 2 капли раствора соляной кислоты и содержимое пробирки встряхните до полного растворения осадка. К студенистому осадку во второй пробирке приливайте по каплям гидроксид натрия, каждый раз встряхивая содержимое пробирки, пока не произойдёт растворение осадка. Запишите наблюдения.
Приведите уравнения растворения гидроксида алюминия в кислоте и в щелочи. Уравнения реакций запишите в молекулярном и ионном виде. Сделайте вывод о кислотно-основных свойствах гидроксида алюминия.
