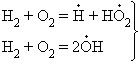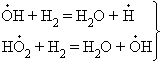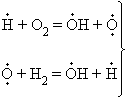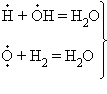Продолжение (развитие цепей)
Рассмотрим вторую стадию цепных реакций - развитие цепей. При этом будем различать реакции с простыми и разветвляющимися цепями. В первом случае каждый исчезающий атом или радикал вызывает появление лишь одного нового атома или радикала.
Примером такой неразветвленной цепи может служить упоминавшаяся выше реакция между Н2 и Br2.
H2 + Br2 = 2HBr,
инициирование которой определяется термо- и фотодиссоциацией:
инициирование:
![]()
рост цепи (развитие):
![]() ,
, ![]()
обрыв цепи:
![]()
В реакциях с разветвляющимися цепями на каждый исчезающий центр реакции возникает несколько новых. К числу таких реакций, в частности, принадлежит уже рассматривавшийся процесс окисления водорода. При низких давлениях и температуре около 500° C он может развиваться согласно следующей схеме:
|
|
|
|
|
|
|
|
Существование свободных атомов и радикалов было доказано различными методами. Так, в реакционную смесь вводят специальные зонды, снабженные чувствительными малоинерционными термопарами, покрытыми катализаторами. На поверхности таких катализаторов происходят процессы рекомбинации атомов и радикалов, сопровождающиеся значительным выделением тепла. Например, катализатор ZnO·Cr2O3 ускоряет реакцию рекомбинации атомов водорода. По повышению температуры зонда можно определить концентрацию свободных частиц. Спектроскопическим путем определяют концентрацию радикалов ОН. В последнее время возникающие при цепных реакциях радикалы исследуются методом электронного парамагнитного резонанса.
Обрыв цепи
Последняя, третья, стадия цепных реакций представляет собой процесс гибели активных частиц (атомов и радикалов).
Гибель переносчиков цепи при столкновениях со стенкой S реакционного сосуда происходит по механизму типа:
![]()
В этих случаях скорость реакции обрыва пропорциональна концентрации свободных радикалов - так называемый линейный обрыв. Чем больше отношение площади поверхности сосуда к его объему, тем интенсивнее гибель переносчиков цепи на стенке, тем короче цепь и меньше скорость реакции.
Обрыв цепи вследствие столкновений радикалов - переносчиков цепи друг с другом и взаимного насыщения свободного валентности в объеме сосуда обычно происходит с участием третьей частицы М, роль которой состоит в отводе энергии от образующейся частицы:
![]()
В этих случаях обрыв цепи является реакцией второго порядка по концентрации свободных радикалов, а ее скорость пропорциональна произведению их концентраций - так называемый квадратичный обрыв.
Линейный обрыв
цепи возможен и вследствие хим.
взаимодействия переносчиков цепи с
примесным веществом, если при этом
образуется радикал, не участвующий в
реакциях продолжения цепи. Так, переносчик
цепи![]() реагирует
с примесным О2 с образованием
реагирует
с примесным О2 с образованием![]() который не участвует в реакциях
продолжения цепи и исчезает при
столкновении с др. частицей
который не участвует в реакциях
продолжения цепи и исчезает при
столкновении с др. частицей![]() или с атомами
или с атомами![]()
Важнейший характерный признак Ц. р.- обрыв цепей на молекулах ингибитора- вещества, эффективно взаимодействующего с переносчиком цепи и дезактивирующего его в результате хим. превращения.
В случае введения в хим. систему т. наз. слабого ингибитора Ц. р. длительное время протекает медленнее, чем в его отсутствие. При добавке так называемого сильного ингибитора Ц. р. практически не наблюдается в течение некоторого периода индукции, после чего ее скорость становится такой же, как и без ингибитора. В отдельную группу выделяют ингибиторы цепного окисления орг. вещества - антиоксиданты. Эффективными природными антиоксидантами являются аскорбиновая кислота и токоферол.
Явление обрыва цепей было продемонстрировано в сыгравших решающую роль в развитии учения о цепных реакциях опытах Н.Н. Семенова, показавшего, что добавление инертного газа (Ar) оказывает влияние на ход реакции между парами фосфора (P4) и кислородом. При низких давлениях цепи обрываются из-за взаимодействия активных центров - атомов кислорода со стенками сосуда. Повышение давления аргона затрудняет диффузию атомов кислорода к стенкам сосуда. Вследствие этого в объеме происходит цепная реакция окисления, развитие которой сопровождается так называемым холодным пламенем.