
- •Государственное образовательное учреждение высшего профессионального образования «Кировская государственная медицинская академия»
- •Министерства здравоохранения и социального развития Российской Федерации
- •Общий уход за детьми
- •С хирургическими заболеваниями
- •Рецензенты: заведующий кафедрой детской хирургии Астраханской государственной медицинской академии доктор медицинских наук, профессор а.А. Жидовинов;
- •Содержание
- •Список условных сокращений
- •Предисловие
- •1. Организация хирургической помощи детям в России
- •Российские хирургические центры. Научно-исследовательские институты. Хирургические клиники медицинских вузов. Республиканские специализированные центры.
- •2. Специализированные отделения областной больницы (абдоминальное, торакальное, нейрохирургичекое, урологическое, отделение плановой и экстренной хирургии и т.Д.)
- •3. Городские и межрайонные специализированные отделения неотложной и плановой хирургии
- •4. Хирургические отделения районных больниц и медико-санитарных частей
- •5. Участковые больницы, амбулатории, хирургические кабинеты амбулаторий. Фельдшерско-акушерские пункты, центры врачей общей практики
- •Структура и организация работы детской хирургической клиники
- •1.2. Структура и организация работы хирургического кабинета детской поликлиники
- •1.3. Контрольные вопросы
- •Тестовые задания
- •Анатомо-физиологические особенности организма ребенка
- •2.1. Анатомо-физиологические особенности кожи и подкожно-жировой клетчатки
- •2.2. Анатомо-физиологические особенности костно-мышечной системы
- •2.3. Анатомо-физиологические особенности дыхательной системы
- •2.4. Анатомо-физиологические особенности сердечнососудистой системы
- •2.5. Анатомо-физиологические особенности нервной системы
- •2.6. Анатомо-физиологические особенности желудочно-кишечного тракта
- •2.7. Анатомо-физиологические особенности мочевыделительной системы
- •2.8. Анатомо-физиологические особенности эндокринной системы
- •2.9. Анатомо-физиологические особенности иммунной системы
- •2.10. Контрольные вопросы
- •Тестовые задания
- •Асептика и антисептика
- •Физический:
- •Контрольные вопросы
- •Тестовые задания
- •Функциональные обязанности персонала, осуществляющего уход за детьми с хирургическими заболеваниями. Работа в перевязочной и в операционном отделении
- •Функциональные обязанности медицинской сестры процедурного кабинета:
- •Функциональные обязанности перевязочной медсестры хирургического отделения:
- •4.1. Контрольные вопросы
- •Тестовые задания
- •5. Важнейшие медицинские манипуляции
- •5.1. Контрольные вопросы
- •Тестовые задания
- •Подготовка детей к специальным методам диагностики и лечения
- •6.1. Подготовка детей к специальным методам обследования
- •6.2. Подготовка детей к оперативному вмешательству
- •6.3. Контрольные вопросы
- •Тестовые задания
- •Перечень практических навыков и умений, которыми должен овладеть студент
- •Ситуационные задачи
- •Эталоны правильных ответов
- •Список рекомендуемой литературы
Асептика и антисептика
Предупреждение инфицирования и борьба с микроорганизмами, попавшими в рану, осуществляются с помощью мероприятий, получивших название «асептика» и «антисептика». До введения методов асептики и антисептики послеоперационная смертность во всем мире достигала 80%, что в первую очередь было обусловлено гнойными инфекционными осложнениями.
В 1885 году русский хирург М.С. Субботин впервые оборудовал специальную операционную, в которой производил стерилизацию перевязочного материала, чем по существу предварил асептические технологии. В последующие годы Э. Бергман детально разработал и предложил метод асептики. Используя открытия Л. Пастера, совместно со своим учеником Шиммельбушем он обосновал методику уничтожения микробов на всем, что соприкасается с операционной раной. В связи этим Э. Бергман считается основателем асептики.
АСЕПТИКА – это комплекс мероприятий, направленных на предупреждение попадания микроорганизмов в рану. Она достигается путем стерилизации – т.е. уничтожения микроорганизмов на руках медперсонала, инструментарии, перевязочном и шовном материале, белье и т.д.
Основной закон асептики - «все, что соприкасается с раной, должно быть стерильно». Все материалы, подлежащие обеззараживанию, должны пройти последовательно следующие этапы обработки:
1) дезинфекцию,
2) предстерилизационную очистку,
3) стерилизацию.
Данные этапы обработки регламентированы приказом МЗ СССР №770 от 10.06.1985 г., где введен отраслевой стандарт 42-21-2-85 «Стерилизация и дезинфекция изделий медицинского назначения. Методы, средства и режимы».
Дезинфекция – мероприятия, направленные на уничтожение возбудителей инфекционных заболеваний во внешней среде и на объектах. Выделяют следующие виды дезинфекции.
Профилактическая дезинфекция – проводится постоянно в отсутствие инфекционного больного с целью предотвращения заболеваний в любом количестве.
Очаговая дезинфекция – проводится в случае возникновения инфекционных заболеваний или подозрения на них. Бывает двух видов.
Текущая – дезинфекция в непосредственном окружении больного с целью предупреждения рассеивания возбудителей инфекционных заболеваний в окружающей среде.
Заключительная дезинфекция – это предупреждение распространения возбудителей инфекционных заболеваний через объекты, бывшие в контакте с больным. В отличие от текущей дезинфекции она, как правило, проводится однократно после выздоровления или изоляции инфекционного больного.
Методы и средства дезинфекции:
Физический:
действие высоких температур: обжигание, прокаливание, сжигание, кипячение, пастеризация, действие горячего воздуха, высушивание;
действие лучистой энергии: ультрафиолетовое облучение, ультразвук, радиоактивное и ионизирующие излучение, токи ультравысокой частоты;
действие низких температур: замораживание;
механические приемы: вытряхивание, влажное протирание, стирка.
Биологический – уничтожение патогенных микроорганизмов во внешней среде средствами биологической природы.
Химический – использование химических веществ (дезинфектанты): сульфохлорамин «Д», хлорамин, гипохлорид кальция, перекись водорода, ПАВ (аламинол, «Нико-дез», «Нико-септ», «Самаровка», «Мистраль»), альдегиды (Сайдекс, Гигасепт, Лизофармин-3000).
Выделяют 5 режимов дезинфекции:
I – при вирусных гепатитах, ВИЧ;
II – при кишечных, воздушно-капельных инфекциях;
III – при туберкулезе;
IV – при кандидозах;
V – при дерматофитии.
Дезинфекции подвергают все изделия медицинского назначения, имеющие контакт с раневой поверхностью, кровью, инъекционными средствами (таблица № 2). Обязательным условием для обеспечения полноценного обеззараживания является погружение инструментария в раствор с полным заполнением внутренних каналов и полостей.
Таблица 2.
Дезинфекция медицинского инструментария, расходных материалов
Шприцы, иглы, скальпеля |
3% р-р «Самаровки», 3% р-р «Мистраля», 0,5% р-р сульфохлорантина |
60 мин. (системы разрезаются)
|
Марлевые шарики, запачканные кровью |
6% р-р перекиси водорода, 0,5% р-р сульфохлорантина |
замачивание на 120 мин. |
Термометры |
3% р-р перекиси водорода, 0,5% р-р сульфохлорантина |
1час 20 мин., полное погружение 5 мин. |
Резиновые грелки, пузыри льда |
0,1% р-р сульфохлорантина
|
Двухкратное протирание через 15 мин. |
Подкладные судна, утки |
0,2% р-р сульфохлорантина
|
Полное погружение на 2 часа |
Поверхности аппаратов, мебели |
0,1% р-р сульфохлорантина, 3% р-р «Самаровки» |
Двухкратное протирание через 15 мин. |
Предстерилизационной очистке подвергаются все изделия перед их стерилизацией с целью удаления белковых, жировых, механических загрязнений и остаточных следов лекарственных препаратов. Хирургические инструменты и шприцы замачивают в моющем растворе с полным погружением изделий при температуре 50º С в течение 15 мин. Примерный состав моющего средства: 5 г моющего средства («Лотос», «Астра», «Прогресс»), 17 мл 27,5% перекиси водорода и 978 мл воды. При использовании порошка «Лотос» добавляется ингибитор коррозии – 1,4 г олеата натрия. Следующим этапом обработки является промывание каждого инструмента ватно-марлевым тампоном или щеткой в течение 30 сек, с последующим ополаскиванием под проточной водой в течение 10 мин. Затем инструменты просушивают в сухожаровом шкафу при температуре 85º С или на полотенце до полного исчезновения влаги. После проведения предстерилизационной подготовки проводится контроль качества путем постановки азопирамовой пробы и фенолфталеиновой пробы. Только после этого медицинский инструментарий подвергают стерилизации.
Стерилизация – это полное освобождение мединструментария от микроорганизмов, включая споровые формы, путем воздействия на них физических и химических факторов. Достигается она следующими методами.
Паровой метод – автоклавирование (изделия из стекла, металлов, текстильных материалов, полимерных материалов, резины и латекса, также данным способом стерилизуют растворы).
Воздушный метод – стерилизация в сухожаровом шкафу (изделия из стекла, металла, фарфора).
Химическая стерилизация (холодный метод стерилизации) – дезинфицирующие растворы (изделия из коррозийно-стойких металлов и сплавов, резины, стекла, пластмасс) или газообразные химические вещества – в параформалиновых камерах (эксикаторах) или в газовых камерах.
Метод кипячения – можно осуществлять в любой посуде, над любым источником огня, имеются специальные стерилизаторы-кипятильники самых разных размеров от карманных до больших стационарных (изделия из стекла, металла, резины, латекса, фарфора, этим способом могут стерилизоваться растворы).
Ультразвуковая стерилизация – медицинские инструменты, обработка рук.
Гамма-излучение – стерилизация в заводских условиях (одноразовые шприцы, системы, шовный материал, биопрепараты).
Метод обжигания – обжигание осуществляют горящим спиртом, однако этот метод на современном этапе потерял свою актуальность из-за не надежной стерилизации. Может быть использован при непредвиденных обстоятельствах.
Метод прокаливания – чаще всего прокаливанием стерилизуют иглы и тонкие металлические инструменты над открытым источником огня, однако этот способ ведет к повреждению металлических изделий и применяется на современном этапе только в лабораториях.
Рассмотрим подробнее некоторые из методов стерилизации:
1) Автоклавирование осуществляется паром под давлением в автоклавах. Стерилизуемый материал укладывается в металлические барабаны (биксы) – рисунок № 3. Биксы имеют отверстия для прохождения пара внутрь, которые после стерилизации закрывают. Срок годности материалов в биксах составляет 3 дня. Кроме биксов в современных условиях используются особые пакеты (рис. № 3), срок хранения материалов в них составляет 6 мес. Существует несколько режимов стерилизации различных материалов методом автоклавирования (см. таблицу № 3).
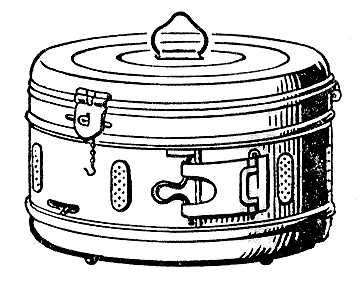

Рис. 3. Бикс и пакеты для стерилизации паром под давлением
Таблица 3.
Режимы стерилизации
Режим
|
Температура, ºС |
Давление, атм. |
Время, мин. |
Вид изделий |
I
|
132 |
2
|
20
|
Изделия из стекла, металлов, текстиль (халаты, перевязочный материал, операционное белье) |
II
|
120 |
1,1 |
45 |
Изделия из стекла, металла, резины, полимерных материалов |
III
|
134 |
2,1 |
5 |
Изделия из металлов, стекла, резины, текстильных материалов |
IV
|
126 |
1,4 |
10 |
Изделия из металлов, стекла, резины, текстильных материалов |
V
|
121 |
1,1 |
20 |
Изделия из резины, латекса, полимеров |
Стерилизация воздушным методом производится в сухожаровом шкафу (рисунок № 4). Наиболее распространены шкафы с электрическим нагревом. Для данного вида стерилизации используются крафтпакеты, срок годности материалов в нем составляет 20 дней (рисунок № 4). Режимы стерилизации отражены в таблице № 4.


Рис. 4. Сухожаровой шкаф и крафтпакет.
3) Стерилизация химическим методом может осуществляться как газообразными химическими веществами, так и растворами. В первом случае объектом стерилизации являются сложные и тонкие приборы, которые под действием растворов или температур могут разрушаться, например, эндоскопы, некоторые сложные изделия из пластмасс и резины. Стерилизацию данным методом осуществляют в газовых камерах или микроанаэростатах – окисью этилена при температуре не менее 18º С, время выдержки 16 часов. Во втором случае инструменты из коррозийно-стойких металлов и сплавов, изделия из резины, стекла и пластмасс погружают в антисептические растворы. После стерилизации инструменты дважды погружают на 5 мин в стерильную дистиллированную воду, меняя ее. Стерильные инструменты выкладывают в бикс, выложенный стерильной простыней. Стерильность сохраняется в течение 3 суток. Для стерилизации применяются различные агенты и режимы:
перекись водорода 6% при температуре 18º С, в течение 6 часов,
перекись водорода 6% при температуре 50º С, в течение 3 часов,
Бинол 20% при температуре 21º С, в течение 10 часов,
Дезоксон I 1% при температуре 18º С, в течение 45 минут,
Гигасепт 10% при температуре 18º С, в течение 10 часов,
Сайдекс 2% при температуре 18º С, в течение 4 часов изделия из стекла и металлов, а изделия из резины и полимерных материалов - 10 часов,
Лизофармин 3000 8% при температуре 40-50º С, в течение 1 часа,
Глутарал 2% в течение 10 часов.
Таблица 4.
Режимы стерилизации воздушным методом в сухожаровом шкафу
Режим |
Температура, ºС |
Время, мин. |
Вид изделий |
I
|
180
|
60 |
Изделия из селиконовой резины, режущие инструменты |
II
|
160 |
150 |
Изделия из селиконовой резины, режущие инструменты |
III
|
200 |
30 |
Изделия из металла, резины |
IV
|
180 |
45 |
Изделия из стекла, металла, резины |
V
|
160 |
150 |
Изделия из резины, латекса, полимеров |
4) Стерилизация методом кипячения. Стерилизуют инструменты в стерильной воде путем двукратного кипячения по 30 минут с интервалом в 6 часов. В воду добавляют щелочь (гидрокарбонат натрия) до получения 2% раствора. Щелочная вода предупреждает окисление и ускоряет стерилизацию. Данным методом можно стерилизовать металлический инструментарий, растворы, изделия из резины, фарфора и стекла.
5) Ультразвуковая стерилизация. Механические колебания с частотой от 2х104 до 2х108 колебаний в 1 секунду не воспринимаются ухом человека и называются ультразвуком. При воздействии на ткани ультразвуковой волны происходит образование микроскопических полостей, которые быстро закрываются под воздействием последующего сжатия. Такое явление называется кавитацией. Ультразвуковая кавитация приводит к образованию свободных радикалов, диссоциации молекул воды на ионы Н+ и ОН-, что приводит к нарушению окислительно-восстановительных процессов в микробной клетке. Ультразвуковые волны используются для стерилизации инструментов, подготовки рук медицинского персонала к операции. Для этого руки (или инструменты) погружают в специальную ванну с дезинфицирующим раствором, через который пропускают ультразвуковые волны.
Стерилизация рук медицинского персонала. Существует множество способов хирургической дезинфекции рук: Спасокукоцкого-Кочергина, способ Фюрбрингера, Альфельда, быстрая стерилизация химическими растворами и т.д. Актуальным на современном этапе остается способ Спасокукоцкого-Кочергина, который заключается в том, что после мытья рук с мылом и щеткой под краном (рисунок № 5), руки обрабатывают 0,5% раствором нашатырного спирта в двух тазах по 3 минуты в каждом. В первом тазу моют руки салфеткой до верхней трети предплечий, особенно тщательно обрабатывают пальцы рук. Во втором тазу моют только кисти и нижнюю часть предплечий. Руки осушают двумя стерильными салфетками, первой – обе кисти, второй – последовательно нижнюю и среднюю часть предплечий. Затем дважды по 2-3 минуты руки обеззараживают марлевыми салфетками, смоченными 96% раствором спирта.
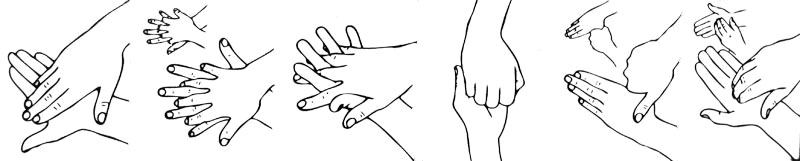
Рис. 5. Этапы обработки рук медицинского персонала
Способы Фюрбрингера и Альфельда сейчас в хирургии не используются из-за высокой токсичности препаратов и того, что они не в полной мере отвечают требованиям надежно убивать микроорганизмы в течение всего времени операции.
В настоящее время применяются отечественные антисептики широкого спектра действия: лизанин, АХД 2000 – СПЕЦИАЛЬ, АХДЕЗ 3000, которые изготовленны на основе этилового спирта, хлоргексидина биглюконата (гибитан) и эфиров жирных кислот. Предварительно руки моют аналогичным способом под теплой проточной водой жидким мылом в течение 2 минут и высушивают стерильной марлевой салфеткой. Затем марлевой салфеткой с данными дезинфицирующими средствами обрабатывают кисти и предплечья в течение 2,5 мин. Эту процедуру выполняют дважды. Надежность и длительность обеззараживания рук этими способами доказана многочисленными исследованиями. В последнее время все большее значение для стерилизации рук медицинского персонала приобретают полиспирты (этанол, бутанол, пропанол-1, пропанол-2, 2-этиленгексанол, н-пропанол, феноксипропанол, а также композиционные средства на их основе в сочетании с другими действующими веществами). Эти полиспирты обладают более быстрым антимикробным действием, не вызывают аллергических реакций и щадяще воздействуют на кожу. Разнообразие в применении антисептических растворов предупреждает развитие резистентных штаммов микроорганизмов. Дальнейшим этапом является асептическая изоляция рук медицинского персонала стерильными резиновыми перчатками рисунок № 6.
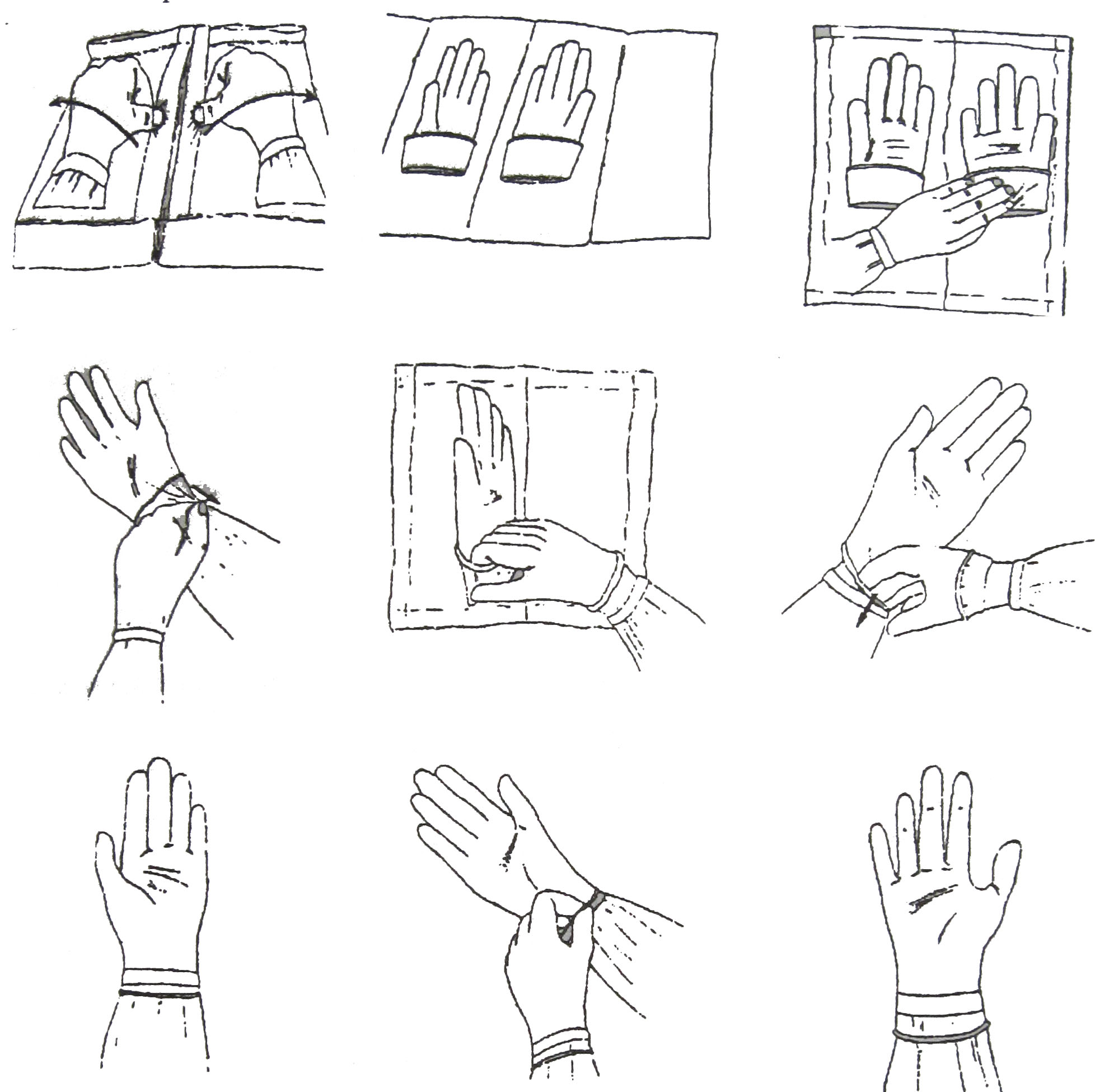
Рис.6. Схема одевания стерильных перчаток.
В настоящее время еще допускается стерилизация перчаток, но после ее проведения латекс и резина теряют свои физические свойства, поэтому во избежание нежелательных осложнений предпочтительнее использовать перчатки один раз.
Важно помнить, что без резиновых перчаток ЗАПРЕЩЕНО выполнять любые виды операций и манипуляций, связанных с контактом с кровью, гноем и физиологическими жидкостями.
Подготовка операционного поля. Предварительная подготовка места оперативного вмешательства начинается с гигиенической обработки, удаления волосяного покрова (бритье) – если таковой имеется. На операционном столе после соответствующей укладки пациента хирург двукратно обрабатывает операционное поле 2% раствором йода, затем 96% спиртом. Место разреза изолируют стерильным бельем и вновь обрабатывают 2% спиртовым раствором йода. Последняя обработка производится перед наложением швов на рану 2% раствором йода, обрабатываются только края раны. Новорожденным и больным с повышенной чувствительностью к препаратам йода операционное поле обрабатывают только 96% спиртом или отдают предпочтение антисептикам широкого спектра действия – лизанину ОП, АХД, 2000 – СПЕЦИАЛЬ, АХДЕС 3000.
Способы контроля стерилизации. Методы контроля стерильности делятся на прямые и непрямые. К прямым методам относят бактериологические исследования. В связи с длительностью проведения исследований (от 3 до 5 дней) этот метод применяется для выборочного контроля стерильности хирургических материалов, по результатам которого судят о методических погрешностях в работе медперсонала или дефектах используемого оборудования. Контроль обсемененности разных объектов и воздуха в хирургических отделениях производится 1 раз в месяц. Выборочный контроль стерильности инструментов, перевязочного материала, рук хирурга, кожи, операционного белья проводят 1 раз в 7 дней.
Непрямые методы контроля используются при термических способах стерилизации, они позволяют определить температуру, при которой производилась стерилизация, не давая ответ на вопрос о присутствии или отсутствии микрофлоры. Так при автоклавировании используют метод Микулича: на полоске фильтровальной бумаги карандашом пишут «СТЕРИЛЬНО», полоску обрабатывают крахмальным клейстером, а затем погружают в водный раствор йода – полоска становится интенсивно синего цвета и надпись перестает быть видимой. Под действием температуры выше 1100С крахмал превращается в декстрин, что приводит к исчезновению синей окраски и надпись «СТЕРИЛЬНО» проявляется. Кроме того используют ампулы с различными веществами, имеющими температуру плавления в пределах 110-120 0С (бензойную кислоту, резорцин, антипирин). После стерилизации если вещество расплавилось, – то материал стерильный, если нет – нагревание было недостаточным и пользоваться таким материалом нельзя – он нестерильный. В настоящее время вместо ампулы используют термоиндикаторные полоски, по изменению цвета которых определяют, достигалась ли во время стерилизации необходимая температура. Для контроля стерилизации в сухожаровом шкафу используются вещества с более высокой точкой плавления (180-190 0С) - аскорбиновая кислота, янтарная кислота, тиомочевина.
АНТИСЕПТИКА – это комплекс мероприятий, направленных на предупреждение развития и борьбу с гнойной инфекцией в ране. Выделяют следующие виды антисептики:
механическая,
физическая,
химическая,
биологическая.
Механическая антисептика включает в себя туалет раны, первичную хирургическую обработку (ПХО) или вторичную обработку раны (ВХО). Туалет раны осуществляется путем промывания раны изотоническими растворами или мыльным раствором под струей воды, кроме того инструментами удаляют инородные тела, отторгшиеся и свободно лежащие в ране. ПХО раны включает в себя иссечение размозженных и некротизированных тканей краев и дна раны с последующим наложением швов. ВХО раны выполняется в случаях, когда раневой процесс осложнился инфекционным воспалением. Некротизированные ткани удаляются, выясняется, нет ли в ране углублений, карманов или затеков, из которых затруднено вытекание экссудата. При наличии затруднений для его свободного оттока ход расширяется, накладываются контрапертуры. Швы на рану не накладываются, операцию завершают дренированием гнойных полостей.
К физической антисептике относятся: открытое ведение и облучение ран ультрафиолетом, лазером, ультразвуком, применение дренажей и т.д. Открытое ведение ран обычно применяется при лечении ожогов. Больные находятся в палатах с высокой температурой и малой влажностью. При этом на ране образуется струп и под воздействием факторов местного иммунитета микроорганизмы погибают. Изоляторы с абактериальной воздушной средой используются для лечения тяжелых форм гнойной инфекции, распространенных термических ожогов. Установка для лечения в абактериальной среде состоит из компрессора и вентилятора для продувания воздуха, бактериального фильтра и камеры со стерильной средой, куда помещают больного или пораженную часть его тела. Существует два основных типа абактериальных изоляторов: общие – палаты или операционные с ламинарным потоком стерильного воздуха и местные - изоляторы для участка тела. Рана в изоляторе находится без повязки.
Гипербарическая оксигенация нашла свое применение при лечении анаэробной клостридиальной и неклостридиальной инфекции, тяжелых форм гнойной и гнилостной инфекции. Создание повышенного парциального давления кислорода от 1,5 до 3 атм. наряду со специфическим лечением способствует быстрому подавлению жизнедеятельности микрофлоры, а также предупреждает прогрессирующий некробиоз тканей.
Ультрафиолетовое излучение используется для уничтожения микробов на раневой поверхности, для облучения крови как экстракорпорально, так и внутри сосудов. Основой антисептического действия на кровь являются разнообразные фотобиологические процессы, обусловленные фотофизическими и фотохимическими реакциями после поглощения квантов света (фотонов) различными биомолекулами. Происходит изменение поверхностных мембранозависимых свойств и функций форменных элементов крови, секреция ими биологически активных веществ, влияющих на состояние различных тканей и органов. Повышается бактерицидность крови, фагоцитарные свойства ее клеток.
Лазерное облучение уменьшает количество микробных ассоциаций и повышает чувствительность бактерий к антибиотикам. Наиболее часто применяют гелий-неоновый лазер (ЛГ-36, ЛГ-75), а также лазеры на СО2. Большая концентрация лазерного облучения на ограниченном участке приводит к испарению тканевых структур. Создается эффект быстрого одномоментного удаления гнойно-некротических тканей, благодаря чему достигается стерилизации раневой поверхности.
Ультразвуковая кавитация используется при лечении гнойных ран. В рану наливают раствор антисептика и вводят наконечник прибора с низкочастотными ультразвуковыми колебаниями. Под воздействием ультразвука в жидкости возникает ряд эффектов (звуковое, радиационное давление, акустические потоки и др.), которые обеспечивают интенсивную очистку поверхности раны, проникновение раствора антисептика на глубину до 3 см. (кожа и мышцы) и до 2-3 мм в костную ткань, что подавляет способность микробов к размножению и вызывает ускорение физиологических репаративных процессов.
Вакуумная обработка гнойных ран за счет значительного отрицательного воздействия вызывает очищение раневой поверхности от детрита и микробных тел.
Дренирование (от англ. drain – осушать) – обеспечение оттока содержимого ран, абсцессов, различных полостей и полых органов. Является основным среди методов физической антисептики. Выделяют следующие виды дренирования: пассивное, активное и осмотическое дренирование. Пассивное дренирование – по хлорвиниловым трубкам или латексным выпускникам (дренажам) осуществляется отток содержимого раны в силу гравитации, и (или) за счет разницы градиентов концентраций (осмотическое дренирование). Дренажи должны обеспечивать адекватный отток содержимого, обладать химической и биологической инертностью, поэтому применение марлевых тампонов и сигарных дренажей в хирургии в качестве дренажей на данный момент ограничены. Применяются же они для остановки капиллярных и паренхиматозных кровотечений, а так же для ограничения распространения гноя и других выделений в свободную полость (желчь, панкреатический сок, моча, лимфа, кишечные выделения). Когда дренируемая полость герметична, например плевральная полость, возможна длительная активная аспирация специальной «гармошкой» или вакуумным отсосом. На данный момент в хирургии широко используются приточно-промывное дренирование, которое осуществляется с помощью двупросветных силиконовых трубок (один конец данной трубки подсоединяется к капельной системе, а по другому осуществляется отток).
Химическая антисептика заключается в обработке ран различными антисептиками. На данный момент существует множество антисептиков, например: раствор перекиси водорода, перманганат калия, фурациллин, этиловый спирт, нитрат серебра, бриллиантовый зеленый, раствор хлоргексидина и т.д.
Биологическая антисептика осуществляется с помощью бактериоцидных, бактериостатических и бактериологических препаратов. Антибиотики прочно вошли в медицину и с каждым годом их количество увеличивается. Связано это с возможностью некоторых возбудителей приобретать резистентность (устойчивость) к этим препаратам. Антибактериальные препараты разделяют по группам, выделяют:
антибиотики пенициллинового ряда – оксациллин, ампициллин, амоксиклав;
цефалоспорины – цефазолин, цефамандол, цефтриаксон, цефепим;
аминогликозиды – гентамицин, тобрамицин, нетромицин, амикацин;
карбапенемы – имипенем, меропенем;
макролиды – азитромицин, джозамицин;
фторхинолоны – ципрофлоксацин;
другие группы – гликопептиды, монобактамы, линкозамиды и т.д.
Антибиотики применяют местно, энтерально и парэнтерально.
Кроме того, с целью биологической антисептики применяют протеолитические ферменты и препараты для пассивной иммунизации – вакцины, сыворотки, гамма-глобулины, анатоксины, бактериофаги, гипериммунную плазму.
