
- •Содержание Часть первая Оценка погрешностей измерений. Запись и обработка результатов
- •6,0220943·1023 Моль-1 116
- •22,41383·10-3 М3/моль 116
- •1 Радиан 117
- •Часть первая Оценка погрешностей измерений. Запись и обработка результатов1
- •§ 1. Измерения, показатели точности измерений
- •§ 2. Погрешности прямых измерений
- •§ 3. Оценка случайной погрешности прямых измерений
- •§ 4. Общая погрешность прямых измерений. Выбор необходимого числа измерений
- •§ 5. Погрешности косвенных измерений
- •§ 6. Точность результата измерений
- •§ 7. Графическая обработка результатов измерений
- •§ 8. Нахождение параметров эмпирической зависимости методом наименьших квадратов
- •§ 9. Общие указания к выполнению лабораторных работ
- •§ 10. Оформление отчета по лабораторной работе
- •Литература
- •Часть вторая Лабораторные работы по молекулярной физике и термодинамике
- •Теория метода
- •Экспериментальная установка
- •Внимание!!!
- •Теория эксперимента
- •Выполнение работы
- •Контрольные вопросы
- •Теория метода
- •Экспериментальная установка
- •Теория эксперимента
- •Выполнение работы
- •Контрольные вопросы
- •Теория метода
- •Экспериментальная установка
- •Теория эксперимента
- •Выполнение работы
- •Контрольные вопросы
- •Теория метода
- •Экспериментальная установка
- •Теория эксперимента
- •Выполнение работы
- •Контрольные вопросы
- •Теория метода
- •Экспериментальная установка
- •Теория эксперимента
- •Выполнение работы
- •Контрольные вопросы
- •Теория метода
- •Экспериментальная установка
- •Теория эксперимента
- •Выполнение работы
- •Контрольные вопросы
- •Теория метода
- •Экспериментальная установка
- •Теория эксперимента
- •Выполнение работы
- •Контрольные вопросы
- •Теория метода
- •Экспериментальная установка
- •Теория эксперимента
- •Выполнение работы
- •Контрольные вопросы
- •Теория метода
- •Экспериментальная установка
- •Теория эксперимента
- •Выполнение работы
- •Контрольные вопросы
- •Приложения
- •1. Значения коэффициентов Стьюдента tα
- •2. Доверительные вероятности α для доверительного интервала, выраженного в долях средней квадратичной ошибки Δа/
- •3. Приближенное определение погрешностей функции z
- •4. Приближенное определение погрешностей функции z
- •5. Устройство и описание работы термостатов tw-2.03 и лаб – тс – 01
- •6. Вывод формулы .
- •7. Значения некоторых постоянных
Контрольные вопросы
1. Покажите, что в условиях опыта концентрацию газов можно считать постоянной по всему объему сосуда V2 (и V1).
2. Почему следует ожидать, что график зависимости D от 1/Р должен иметь вид прямой линии?
3. От каких параметров зависит коэффициент диффузии?
4. Охарактеризуйте применяемый в работе метод измерения коэффициента взаимной диффузии газов.
5. Почему вблизи поверхности датчика происходит температурный скачок?
6. Какие еще явления переноса Вы знаете? Какая связь существует между коэффициентами переноса?
Лабораторная работа №9
ЭФФЕКТ ДЖОУЛЯ-ТОМСОНА
Цель работы: Овладеть методикой определения коэффициента Джоуля-Томсона. Определить коэффициент Джоуля-Томсона и его зависимость от температуры.
Литература:
1. Кикоин А.К., Кикоин И.К. Молекулярная физика. — М.: Наука, 1976, гл. III, § 111.
2. Сивухин Д.В. Общий курс физики. Т.2. Термодинамика и молекулярная физика — М.: Наука, 1990, §§ 97, 98, 104.
3. Фриш С. Э., Тиморева А. В. Курс общей физики. Т. I. Физические основы механики. Молекулярная физика. Колебания и волны. – М.: Физматгиз, 1961, гл. VII, §§ 64, 65.
4. Лабораторные занятия по физике. /Под ред. Гольдина Л.Л. – М.: Наука. Главная редакция физико-математической литературы, 1983. – 704 с.
5. Введение в технику эксперимента/ Составитель: Беленко И.А. – БелГУ, 2004. – 124 с.
Приборы, оборудование и их характеристики:
Трубка с пористой перегородкой;
Термостат TW – 2.03;
Дифференциальная термопара медь – константан;
Цифровой вольтметр В7 – 46/1;
Форвакуумный насос 3НВР – 1Д.
Теория метода
Эффектом Джоуля — Томсона называется изменение температуры газа, медленно протекающего из области высокого в область низкого давления через пористую перегородку в условиях хорошей тепловой изоляции. В разреженных газах, которые приближаются по своим свойствам к идеальному газу, при таком течении температура газа не меняется. Эффект Джоуля — Томсона демонстрирует отличие исследуемого газа от идеального.
Коэффициентом Джоуля–Томсона называется отношение
![]() ,
,
где
![]() –
изменение температуры при течении газа
из одной области в другую, перепад
давлений между которыми
.
–
изменение температуры при течении газа
из одной области в другую, перепад
давлений между которыми
.
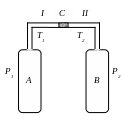
Рис. 1. Опыт Джоуля-Томсона.
Рассмотрим стационарный поток газа между произвольными сечениями I и II трубки (до пористой перегородки С и после нее), соединяющей сосуды А и В (рис. 1). Пусть, для определенности, через трубку прошел 1 моль газа; – его масса. Молярные объемы газа, его давления и отнесенные к молю внутренние энергии газа в сечениях I и II обозначим соответственно V1, P1, U1 и V2, Р2, U2. Для того чтобы ввести в трубку объем V1, над газом нужно совершить работу А1=P1V1. Проходя через сечение II, газ сам совершает работу A2=Р2 V2. Если трубка окружена теплоизолирующим веществом, то через боковые стенки не происходит ни обмен теплом, ни передача механической энергии и
![]() .
(1)
.
(1)
В уравнении (1) учтено изменение как внутренней (первые члены в скобках), так и кинетической (вторые члены в скобках) энергии газа. Подставляя в (1) написанные выражения для А1 и А2 и перегруппировывая члены, найдем
H1
–H2
=(U1
+ P1V1)
– (U2
+ P2V2)
=
![]() (2)
(2)
Входящая в это выражение величина
H = U +PV. (3)
носит название энтальпии. Формула (2) полностью описывает процесс стационарного течения газа.
Сделаем несколько замечаний. Прежде всего, отметим, что при процессе Джоуля – Томсона газ испытывает в пористой перегородке существенное трение, приводящее к ее нагреву. Потери энергии на нагрев трубки в начале процесса могут быть очень существенными и сильно искажают ход явления. После того как температура трубки установится и газ станет уносить с собой все выделенное им в перегородке тепло, формула (1) становится точной, — если, конечно, теплоизоляция трубки достаточно хороша и не происходит утечек тепла наружу через ее стенки.
Второе замечание связано с правой частью (2). Процесс Джоуля — Томсона в чистом виде осуществляется лишь в том случае, если правой частью можно пренебречь, т.е. если скорость газа с обеих сторон трубки достаточно мала. У нас сейчас нет критерия, который позволил бы установить, когда это можно сделать. Поэтому мы отложим на некоторое время обсуждение вопроса о правой части (2), а пока будем считать, что энтальпия газа не меняется, т. е.
H1 =H2. (4)
Рассмотрим эффект Джоуля — Томсона в идеальном газе. Для идеального газа внутренняя энергия U является функцией одной только температуры. Произведение РV равно RТ и тоже зависит только от температуры. Поэтому и энтальпия идеального газа зависит от одной только температуры. При процессе Джоуля — Томсона энтальпия, а значит и температура идеального газа, не меняется. Поэтому, как уже указывалось, изменение температуры в рассматриваемом процессе и является чувствительным индикатором, указывающим на отличие реальных газов от идеального.
Заметим теперь, что энтальпия газа, подобно его энергии, объему и давлению, является функцией состояния. Это означает, что, вычисляя изменение энтальпии при переходе от сечения I к сечению II, нет нужды детально следить за ходом процесса Джоуля — Томсона, что сделать очень непросто, так как процесс протекания газа через пористую перегородку не может быть рассчитан простыми методами. Вместо этого можно рассчитать изменение энтальпии при любом другом процессе, происходящем между тем же начальным и конечным состояниями. Выберем для расчета обратимый процесс, для которого нетрудно написать точные формулы.
При дальнейшем рассмотрении мы ограничимся малыми перепадами Р и, иначе говоря, будем рассматривать дифференциальный эффект Джоуля–Томсона. Выберем в качестве независимых переменных давление и температуру. Тогда
![]() .1
(5)
.1
(5)
Коэффициент
Джоуля — Томсона
![]() ,
следовательно, равен
,
следовательно, равен
![]() (6)
(6)
Рассмотрим производные, входящие в эту формулу. Заметим, что в силу первого закона термодинамики
Q = dU + PdV = d(U + PV) – VdP = dH – VdP.
Рассмотрим процесс при постоянном Р. Тогда второй член формулы обращается в нуль. Разделим обе части формулы на dT:
(Q/dT)p = (dH/dT)p.
Левая часть этого равенства (по определению) равна теплоемкости при постоянном давлении СР. Поэтому
![]() (7)
(7)
Можно показать (см. приложение 6), что
![]() .
(8)
.
(8)
Поэтому
![]() .
(9)
.
(9)
