
- •1. Теория электролитической диссоциации
- •1.1. Примеры решения задач
- •2. Растворы сильных электролитов. Активность электролитов
- •2.1. Примеры решения задач
- •2.2. Задачи для самостоятельного решения
- •3. Ионное произведение воды. Водородный показатель
- •3.1. Примеры решения задач
- •3.2. Задачи для самостоятельного решения
- •4. Растворы солей в воде и их гидролиз
- •4.1. Примеры решения типовых задач
- •4.2. Задачи для самостоятельного решения
- •5. Труднорастворимые соли. Произведение растворимости
- •5.1. Примеры решения типовых задач
- •5.2. Задачи для самостоятельного решения
- •6. Окислительно-восстановительные реакции
- •6.1. Определение коэффициентов уравнений окислительно-восстановительных реакций методом электронного баланса
- •6.2. Определение коэффициентов уравнений окислительно-восстановительных реакций методом ионно-электронного баланса
- •6.3. Задачи для самостоятельного решения
- •7. Электропроводность растворов электролитов. Числа переноса
- •7.1. Примеры решения задач
- •7.2. Задачи для самостоятельного решения
- •8. Электрохимические процессы на электродах. Типы электродов. Электродный потенциал
- •8.1.Примеры решения задач
- •8.2. Задачи для самостоятельного решения
- •9. Электролиз. Законы Фарадея
- •9.1. Примеры решения задач
- •9.2. Задачи для самостоятельного решения
- •10. Химические источники тока
- •10.1. Примеры решения задач
- •10.2. Задачи для самостоятельного решения
- •Библиографический Список
- •Приложения
- •Оглавление
3. Ионное произведение воды. Водородный показатель
Вода является слабым электролитом и диссоциирует по уравнению
![]() (3.1)
(3.1)
Константа диссоциации воды очень мала, при 25 С
 (3.2)
(3.2)
Из-за незначительной степени диссоциации можно концентрацию воды [H2O] принять неизменной и равной 1000/18=55,56 моль/л. Тогда при стандартной температуре
![]() (3.3)
(3.3)
Для воды и всех водных растворов произведение концентрации ионов водорода и ионов гидроксида называется ионным произведением воды КВ. Ионное произведение воды – величина постоянная при неизменной температуре. Постоянство ионного произведения воды дает возможность в любых растворах вычислить концентрацию ионов [H+], если известна концентрация ионов [ОH–], и наоборот:
 (3.4)
(3.4)
При стандартной температуре 298 К в чистой воде и нейтральных растворах [H+]=[ОH–]=10–7 моль/л. В кислых растворах [H+]>10–7 моль/л, а в щелочных [H+]<10–7 моль/л. Удобной характеристикой среды является водородный показатель pH, который равен десятичному логарифму концентрации водородных ионов, взятому со знаком минус,
![]() . (3.5)
. (3.5)
Для нейтральной среды pH=7, для кислой pH<7 и для щелочной pH>7. Если выражение для ионного произведения поды прологарифмировать и поменять знаки на обратные, то получим для 25 С
![]() (3.6)
(3.6)
то есть сумма водородного и гидроксидного показателей равна 14.
Замечание. Константа диссоциации воды, а значит ионное произведение и pH, зависят от температуры. Например, для ледяной воды (~0 С) КВ=0,11410–14, pH=7,472; для предельно горячей воды (~100 С) КВ=59,010–14, pH=6,115.
Для растворов кислот pH может быть вычислен, если известна константа диссоциации кислоты. Для любой кислоты HкАа

выражение константы диссоциации
 (3.7)
(3.7)
позволяет вычислить степень диссоциации , концентрацию ионов водорода и водородный показатель
![]() (3.8)
(3.8)
Для слабой одно-однозарядной (к=1, а=1) кислоты, например уксусной CH3COOH, эти формулы существенно упрощаются (<<1)
 (3.9)
(3.9)
Для растворов щелочи
![]()
получим после аналогичных рассуждений
 (3.10)
(3.10)
а для слабого одно-однозарядного основания, например NH4OH, Kд<<1, к=a=1, <<1, получим
![]() (3.11)
(3.11)
3.1. Примеры решения задач
Пример 13. Вычислить концентрацию ионов OH– и pH раствора, если концентрация ионов H+ равна: а) 210–4; б) 410–12 моль/л.
Решение
Используя уравнение (3.4), получим:
а)

б)

Пример 14. Вычислить концентрацию ионов H+ и pH раствора, если концентрация ионов OH– равна: а) 410–10; б) 510–6 моль/л.
Решение
Используя уравнение (3.4), получим:
а)
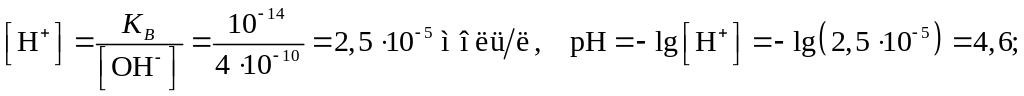
среда кислая.
б)
 среда щелочная.
среда щелочная.
Пример 15. Для раствора pH составляет 6,3. Вычислить концентрации [H+] и [OH–].
Решение
По определению
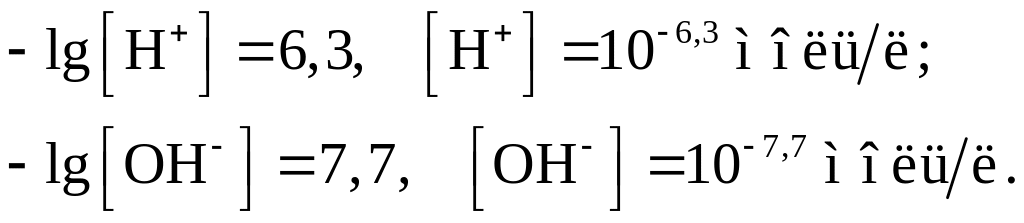
Пример 16. Вычислить pH 1%-ного (мас.) раствора муравьиной кислоты (HCOOH), считая плотность раствора равной 1 г/см3; константа диссоциации кислоты Kд=2,110–4 моль/л.
Решение
В 1 л раствора содержится 10 г муравьиной
кислоты, то есть концентрация
 моль/л. Получим для концентрации ионов
водорода из формулы (3.7).
моль/л. Получим для концентрации ионов
водорода из формулы (3.7).
![]() Среда
кислая.
Среда
кислая.
Пример 17. Вычислить степень диссоциации и pH 0,1 М раствора синильной кислоты. Константа диссоциации HCN равна 6,210–10 моль/л. Как изменится pH среды, если к 1 л 0,1 М раствора HCN добавить 0,2 моля NaCN? Соль считать полностью диссоциированной.
Решение
Определим концентрацию ионов [H+] в исходном растворе:

![]()
Учитывая,
что
![]() ,
получим
,
получим

Среда кислая.
Добавление 0,2 моля NaCN к 1 л 0,1 М раствора HCN приведет к уменьшению концентрации ионов H+ из-за увеличения концентрации ионов CN–. Обозначим концентрацию ионов H+ через х, концентрация ионов CN– будет тогда (х+0,2). Подставим это в выражение для константы диссоциации

так как х очень малая величина. Тогда 0,2х=6,210–11, х=[H+]=3,110–10 моль/л. Определим pH тройного раствора
![]()
Среда стала щелочной.
