
- •1. Теория электролитической диссоциации
- •1.1. Примеры решения задач
- •2. Растворы сильных электролитов. Активность электролитов
- •2.1. Примеры решения задач
- •2.2. Задачи для самостоятельного решения
- •3. Ионное произведение воды. Водородный показатель
- •3.1. Примеры решения задач
- •3.2. Задачи для самостоятельного решения
- •4. Растворы солей в воде и их гидролиз
- •4.1. Примеры решения типовых задач
- •4.2. Задачи для самостоятельного решения
- •5. Труднорастворимые соли. Произведение растворимости
- •5.1. Примеры решения типовых задач
- •5.2. Задачи для самостоятельного решения
- •6. Окислительно-восстановительные реакции
- •6.1. Определение коэффициентов уравнений окислительно-восстановительных реакций методом электронного баланса
- •6.2. Определение коэффициентов уравнений окислительно-восстановительных реакций методом ионно-электронного баланса
- •6.3. Задачи для самостоятельного решения
- •7. Электропроводность растворов электролитов. Числа переноса
- •7.1. Примеры решения задач
- •7.2. Задачи для самостоятельного решения
- •8. Электрохимические процессы на электродах. Типы электродов. Электродный потенциал
- •8.1.Примеры решения задач
- •8.2. Задачи для самостоятельного решения
- •9. Электролиз. Законы Фарадея
- •9.1. Примеры решения задач
- •9.2. Задачи для самостоятельного решения
- •10. Химические источники тока
- •10.1. Примеры решения задач
- •10.2. Задачи для самостоятельного решения
- •Библиографический Список
- •Приложения
- •Оглавление
10. Химические источники тока
Химическими источниками тока (ХИТ) называются устройства, в которых энергия Гиббса пространственно разделенных окислительно-восстановительных процессов превращается в электрическую энергию. Все используемые на практике ХИТ делятся на две группы:
– гальванические элементы (первичные ХИТ), позволяющие однократное использование их активных материалов;
– аккумуляторы (вторичные ХИТ), работоспособность которых после разряда может быть восстановлена зарядкой от внешнего источника постоянного тока.
Конструктивное выполнение ХИТ может быть разнообразным, но в принципе они состоят из двух электродов – проводников электричества первого рода, разделенных электролитом, то есть проводником второго рода. Знаки электродов и общепринятые их названия соответствуют протекающим на них окислительному (анод, минус) и восстановительному (катод, плюс) процессам. При работе ХИТ получающиеся на аноде электроны «перетекают» по внешней цепи к катоду. Природа и направление потока ионов в электролите работающего ХИТ определяется в каждом конкретном случае. Главной величиной, характеризующей служебные характеристики ХИТ, является электродвижущая сила (ЭДС, Е). Она определяется разностью потенциалов катода и анода
![]() ,
,
каждый из которых рассчитывается по уравнению Нернста (см. главу 8). Рассмотрим несколько примеров гальванических элементов и аккумуляторов.
Простейший пример – медно-цинковый элемент
![]() (10.1)
(10.1)
изобретенный в 1836 г. английским ученым
и изобретателем Д.Ф. Даниелем. Этот
элемент – первый в мире устойчивый
источник постоянного электрического
тока (рис. 3). Металлические пластины
(цинк и медь) опущены в водные растворы
сернокислых солей. Электролиты разделены
полупроницаемой перегородкой (мембрана,
солевой мостик), исключающей перемешивание
электролитов, но позволяющей проходить
ионам
![]() .
Катодный процесс в этом элементе –
восстановление меди из раствора
сернокислой меди
.
Катодный процесс в этом элементе –
восстановление меди из раствора
сернокислой меди
![]() ;
;

Рис. 3. Схема элемента Даниеля–Якоби
равновесный электродный потенциал медного катода (при раздвинутой внешней цепи, I = 0)
![]() (10.2)
(10.2)
где стандартный электродный потенциал
(25 °С,
![]() = 1)
= 1)
![]() = +0,337 В;
– активность ионов меди в растворе
электролита. (Здесь и далее активность
определена для концентрации, выражаемой
в моль/л). Анодный процесс – окисление
и растворение цинка, его равновесный
потенциал
= +0,337 В;
– активность ионов меди в растворе
электролита. (Здесь и далее активность
определена для концентрации, выражаемой
в моль/л). Анодный процесс – окисление
и растворение цинка, его равновесный
потенциал
![]() ,
,
![]() , (10.3)
, (10.3)
где
![]() =
–0,763 В;
=
–0,763 В;
![]() – активность ионов цинка. Суммарный
потенциалобразующий процесс (реакция)
в работающем элементе
– активность ионов цинка. Суммарный
потенциалобразующий процесс (реакция)
в работающем элементе
![]() ,
,
а электродвижущая сила элемента Даниеля.
 . (10.4)
. (10.4)
Замечание. Для приблизительных расчетов ЭДС можно в уравнении (10.4) отношение активностей заменить отношением концентраций, моль/л
 или
или
 , (10.5)
, (10.5)
тогда
 . (10.6)
. (10.6)
Рассмотрим более сложный пример – марганцово-цинковый гальванический элемент (МЦЭ)
![]() . (10.7)
. (10.7)
В этом элементе анод – чистый металлический цинк, электрохимически растворяющийся при работе элемента
![]() . (10.8)
. (10.8)
Потенциал анодного процесса
![]() . (10.9)
. (10.9)
Катод в этом элементе представляет
собой графитовый стержень (пластину),
на который напрессована активная смесь
оксида
![]() с графитом. Катодный процесс
с графитом. Катодный процесс
![]() , (10.10)
, (10.10)
а электродный потенциал в предположении,
что активности
![]() ,
и
,
и
![]() равны единице,
равны единице,
 . (10.11)
. (10.11)
Электродвижущая сила элемента
 , (10.12)
, (10.12)
то есть ЭДС зависит от концентрации
ионов
![]() в электролите и рН электролита. Если
теперь при определении суммарной
потенциалобразующей реакции сложить
анодную (10.8) и катодную (10.10) реакции, то
получившееся уравнение
в электролите и рН электролита. Если
теперь при определении суммарной
потенциалобразующей реакции сложить
анодную (10.8) и катодную (10.10) реакции, то
получившееся уравнение
![]()
будет ошибочным. Это объясняется протеканием в элементе пяти вторичных процессов. Один из них
![]() (10.13)
(10.13)
приводит к образованию на цинковом
электроде труднорастворимой соли.
«Освободившиеся» ионы
![]() с получающимися в катодном процессе
ионами
с получающимися в катодном процессе
ионами
![]() образуют слабый электролит
образуют слабый электролит
![]() , (10.14)
, (10.14)
который разлагается
![]() . (10.15)
. (10.15)
Марганцево-цинковый элемент – герметично замкнутая система, поэтому газообразный аммиак вступает в реакцию образования
![]() . (10.16)
. (10.16)
И, наконец, получающийся на катоде оксид образует кристаллогидрат
![]() . (10.17)
. (10.17)
Комбинирование реакций первичных (10.8) и (10.10) и вторичных (10.13–10.16) реакций позволяет определять суммарную реакцию уравнением
![]() . (10.18)
. (10.18)
В качестве примера вторичного ХИТ рассмотрим работу свинцового аккумулятора (изобретен в 1859 г., теория свинцового аккумулятора разработана в 1882 г.)
![]() .
.
Процесс на левом электроде
![]() (10.19)
(10.19)
протекает при работе (разряде) аккумулятора
слева направо (анодный процесс) с
образованием труднорастворимой соли
![]() ,
произведение растворимости которой
,
произведение растворимости которой
 ,
а при зарядке – справа налево (катодный
процесс). Для работающего аккумулятора
потенциал анода
,
а при зарядке – справа налево (катодный
процесс). Для работающего аккумулятора
потенциал анода
 (В). (10.20)
(В). (10.20)
Процесс на правом электроде
![]() (10.21)
(10.21)
протекает при работе аккумулятора слева направо (катодный процесс) и его потенциал
 (В). (10.22)
(В). (10.22)
При зарядке процесс (10.21) протекает справа налево (анодный процесс). Суммарный потенциалобразующая реакция в работающем свинцовом аккумуляторе
![]() . (10.23)
. (10.23)
ЭДС аккумулятора (В)
![]()
![]() (10.24)
(10.24)
зависит от концентрации серной кислоты и уменьшается по мере работы из-за расхода кислоты.
Другими (кроме ЭДС) служебными характеристиками ХИТ являются:
– полное внутреннее сопротивление
![]() ;
;
– разрядное напряжение
![]() ;
;
– зарядное напряжение
![]() ;
;
– разрядная емкость – количество электричества, которое может быть получено от ХИТ
![]() ,
в простейшем случае при
,
в простейшем случае при
![]()
![]() ;
;
– расход активных веществ в расчете на 1 А·ч;
– коэффициент (доля) использования активных веществ;
– зарядная емкость
![]() ,
,
![]() ;
;
– мощность – количество отдаваемой энергии в единицу времени;
– саморазряд – бесполезная потеря емкости при разомкнутой внешней цепи.
Снимаемое в реальных
условиях эксплуатации напряжение
разряда
![]() меньше определяемой по уравнению Нернста
равновесной электродвижущей силы
меньше определяемой по уравнению Нернста
равновесной электродвижущей силы
![]() (см., например, уравнения 10.4, 10.12, 10.24)
из-за поляризационных эффектов
(см., например, уравнения 10.4, 10.12, 10.24)
из-за поляризационных эффектов
![]() .
.
Расход активных веществ при работе ХИТ рассчитывается по законам Фарадея. Для примера покажем расчет расхода активных веществ при работе свинцового аккумулятора. Уравнения анодного (10.19), катодного процесса (10.21) и суммарной потенциал-образующей реакции (10.23) записаны на два Фарадея электричества, поэтому расходы активных веществ на получение 1 А·ч электричества следует оценивать следующим образом.
Массы израсходованных свинца, его оксида и серной кислоты
 ;
;
 ;
;
 .
.
Массы получающихся воды и труднорастворимой соли
 ;
;
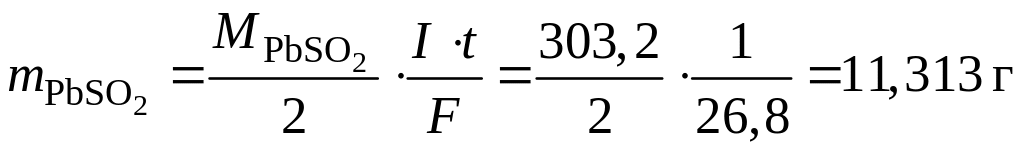 .
.
При работе ХИТ выделяется или поглощается теплота, поэтому величины электродных потенциалов и ЭДС зависят от температуры. Эти зависимости определяют в виде ряда
 , (10.25)
, (10.25)
 . (10.26)
. (10.26)
Величины первого и второго термических коэффициентов приведены в справочниках. В приближенных расчетах величинами вторых коэффициентов пренебрегают и считают потенциалы и ЭДС линейными функциями температуры.
Влияние температуры на характеристики ХИТ можно оценить, если связать электродвижущую силу и изменение энергии Гиббса для потенциалобразующей (суммарной) химической реакции в ХИТ. Рассмотрим простой пример. Для гальванического элемента Даниэля
![]()
ЭДС определяется соотношением
 . (10.27)
. (10.27)
Возможность и направление протекания потенциалобразующей реакции этого гальванического элемента
определяется уравнением изотерм химической реакции
 . (10.28)
. (10.28)
Соотношения между ЭДС и термодинамическими характеристиками реакции определяются следующими уравнениями:
![]() , (10.29)
, (10.29)
![]() , (10.30)
, (10.30)
где
![]() – стандартное изменение энергии Гиббса;
K – константа равновесия
реакции; n – число
электронов.
– стандартное изменение энергии Гиббса;
K – константа равновесия
реакции; n – число
электронов.
Так как ХИТ работают в узком температурном интервале, близком к стандартной температуре Т = 298 К, можно без большой ошибки считать
![]() и
и
![]() .
.
С учетом известных термодинамических соотношений

можно получить такие уравнения
 , (10.31)
, (10.31)
 , (10.32)
, (10.32)
 . (10.33)
. (10.33)
В этих формулах
![]() – работа гальванического элемента, а
– работа гальванического элемента, а
 – теплота, выделяющаяся
– теплота, выделяющаяся
![]() или поглощающаяся
или поглощающаяся
![]() при работе ХИТ. Если формулу (10.32) записать
в виде
при работе ХИТ. Если формулу (10.32) записать
в виде
 , (10.34)
, (10.34)
то видно, что при
![]() химический источник тока превращает в
полезную работу не только теплоту
реакции, но и некоторое количество
энергии, поглощаемое в виде теплоты из
окружающей среды.
химический источник тока превращает в
полезную работу не только теплоту
реакции, но и некоторое количество
энергии, поглощаемое в виде теплоты из
окружающей среды.
