
- •1. Теория электролитической диссоциации
- •1.1. Примеры решения задач
- •2. Растворы сильных электролитов. Активность электролитов
- •2.1. Примеры решения задач
- •2.2. Задачи для самостоятельного решения
- •3. Ионное произведение воды. Водородный показатель
- •3.1. Примеры решения задач
- •3.2. Задачи для самостоятельного решения
- •4. Растворы солей в воде и их гидролиз
- •4.1. Примеры решения типовых задач
- •4.2. Задачи для самостоятельного решения
- •5. Труднорастворимые соли. Произведение растворимости
- •5.1. Примеры решения типовых задач
- •5.2. Задачи для самостоятельного решения
- •6. Окислительно-восстановительные реакции
- •6.1. Определение коэффициентов уравнений окислительно-восстановительных реакций методом электронного баланса
- •6.2. Определение коэффициентов уравнений окислительно-восстановительных реакций методом ионно-электронного баланса
- •6.3. Задачи для самостоятельного решения
- •7. Электропроводность растворов электролитов. Числа переноса
- •7.1. Примеры решения задач
- •7.2. Задачи для самостоятельного решения
- •8. Электрохимические процессы на электродах. Типы электродов. Электродный потенциал
- •8.1.Примеры решения задач
- •8.2. Задачи для самостоятельного решения
- •9. Электролиз. Законы Фарадея
- •9.1. Примеры решения задач
- •9.2. Задачи для самостоятельного решения
- •10. Химические источники тока
- •10.1. Примеры решения задач
- •10.2. Задачи для самостоятельного решения
- •Библиографический Список
- •Приложения
- •Оглавление
1. Теория электролитической диссоциации
Электролиты – твердые и жидкие вещества, молекулы которых в результате электростатического взаимодействия с молекулами полярного растворителя распадаются (диссоциируют) на ионы. Часто для краткости электролитами называют водные растворы кислот, оснований и солей, солевые и оксидные расплавы. Существование в растворах электролитов заряженных частиц определяет специфические свойства таких систем и, в первую очередь, их высокую электропроводность и протекание окислительно-восстановительных процессов на поверхности электродов, опущенных в раствор. С. Аррениус в 1884–87 гг. первым высказал предположение об увеличении числа частиц в растворе в результате диссоциации электролитов и на основании этого разработал элементарную теорию электролитической диссоциации, применимую для описания равновесий в растворах слабых электролитов.
Важнейшими характеристиками раствора электролита являются константа диссоциации и степень диссоциации. Степень диссоциации определяет долю молекул (молей) электролита, распавшихся на ионы, по отношению к числу молекул (молей) электролита, введенных в раствор. Степень диссоциации изменяется в пределах от =0 до =1. Плохо диссоциирующие электролиты <<1 называют слабыми. Для сильных электролитов 1. Константа диссоциации (константа равновесия процесса электролитической диссоциации) связана со степенью диссоциации.
Например, для водных растворов бинарных одно-однозарядных (HCl, HNO3, CH3COOH, NaCl и др.) и двух-двухзарядных электролитов (ZnSO4, CuS, AlPO4 и др.) для процесса диссоциации

константы диссоциации определяются уравнениями
 (1.1)
(1.1)
В этих уравнениях
![]() ,
,
![]() ,
,
![]() и т.д. – равновесные концентрации ионов
и непродиссоциировавших молекул
электролитов, моль/л;
и т.д. – равновесные концентрации ионов
и непродиссоциировавших молекул
электролитов, моль/л;
![]() – концентрация введенных в воду молекул
электролита («начальная» концентрация,
концентрация «по приготовлению»,
концентрация «до диссоциации»), моль/л.
Для сильных электролитов константа
диссоциации большая величина и степень
диссоциации близка к единице (например,
при 25 С Kд(HCl)=107,
1; Kд(HNO3)=37,
=0,995 при
=0,3
моль/л). Для слабых электролитов константа
диссоциации мала, а степень диссоциации
составляет несколько процентов (например,
для уксусной кислоты CH3COOH
Kд=1,8510–5,
=0,013 или 1,3% для
=0,1
моль/л). Поэтому для слабых электролитов
при приближенных расчетах в уравнении
(1.1) в знаменателе пренебрегают слагаемым
по сравнению с
единицей
– концентрация введенных в воду молекул
электролита («начальная» концентрация,
концентрация «по приготовлению»,
концентрация «до диссоциации»), моль/л.
Для сильных электролитов константа
диссоциации большая величина и степень
диссоциации близка к единице (например,
при 25 С Kд(HCl)=107,
1; Kд(HNO3)=37,
=0,995 при
=0,3
моль/л). Для слабых электролитов константа
диссоциации мала, а степень диссоциации
составляет несколько процентов (например,
для уксусной кислоты CH3COOH
Kд=1,8510–5,
=0,013 или 1,3% для
=0,1
моль/л). Поэтому для слабых электролитов
при приближенных расчетах в уравнении
(1.1) в знаменателе пренебрегают слагаемым
по сравнению с
единицей
![]() (1.2)
(1.2)
Однако, для сильно разбавленных растворов
и слабых электролитов
![]() степень диссоциации близка к единице
степень диссоциации близка к единице
![]() ,
поэтому уравнение (1.2) становится
неверным.
,
поэтому уравнение (1.2) становится
неверным.
Для тройных электролитов уравнение, связывающее константу диссоциации со степенью диссоциации, имеет другой вид. Например, для сильного электролита
 . (1.3)
. (1.3)
Для слабого электролита
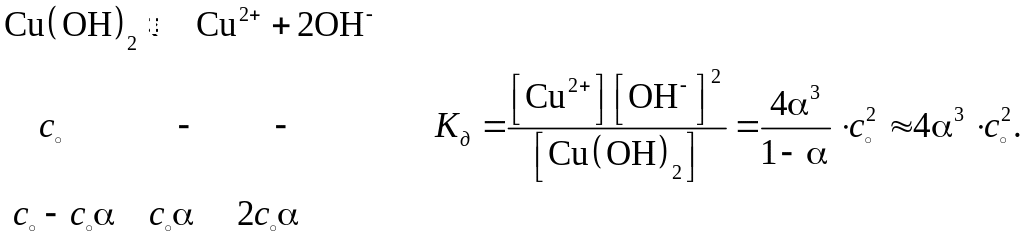 (1.4)
(1.4)
Для более сложных электролитов
 (1.5)
(1.5)
 (1.6)
(1.6)
Замечания.
1. Записанные выше уравнения процессов диссоциации, строго говоря, следует понимать не как равновесие между ионами и непродиссоциировавшими молекулами электролита, а как равновесие между обособленными гидратированными ионами, относительно независимо перемещающимися в растворе, и ионами, образующими пары.
2. Сложные электролиты в водных растворах диссоциируют ступенчато, например:
а)

суммарный процесс получается сложением ступенчатых
![]()
б)
![]()
![]()
суммарный процесс
![]()
Это обстоятельство следует учитывать при точных расчетах, а экспериментально определенную степень диссоциации следует считать кажущейся.
3. Увеличение числа частиц при диссоциации определяется степенью диссоциации:
![]()
![]()
![]()
![]()
Число i, определяющее во сколько раз увеличивается число частиц, называется изотоническим коэффициентом Вант-Гоффа. В общем случае
![]() (1.7)
(1.7)
где – число ионов, получающихся при диссоциации молекулы электролита.
С учетом диссоциации известные закономерности, справедливые для растворов неэлектролитов, должны быть скорректированы:
– закон Рауля
 (1.8)
(1.8)
– эбулиоскопический эффект
![]() (1.9)
(1.9)
– криоскопический эффект
![]() (1.10)
(1.10)
– осмотическое давление
![]() (1.11)
(1.11)
Здесь все формулы написаны для бинарного
раствора; n1, n2
– числа молей компонентов; p1
– давление паров растворителя;
![]() – повышение температуры кипения раствора
электролита; m
– понижение температуры замерзания
раствора; E, K
– эбуллиоскопическая и криоскопическая
постоянные растворителя; с2,
сm2 –
молярная и моляльная концентрации
электролита.
– повышение температуры кипения раствора
электролита; m
– понижение температуры замерзания
раствора; E, K
– эбуллиоскопическая и криоскопическая
постоянные растворителя; с2,
сm2 –
молярная и моляльная концентрации
электролита.
