
- •Кафедра технологии лесохимических продуктов, химии древесины и физической химии сПбГлту
- •Классификация по фазовому взаимодействию
- •II. Физическая конденсация
- •Строение двойного электричяеского слоя (дэс) и падение потенциала с расстоянием по теории т.Штерна
- •Элекирокинетические явления
- •Коагуляция
- •Кинетика коагуляции под действием электролитов
- •Основы теории устойчивости дисперсных систем (длфо)
- •Уравнение изотермы адсорбции Гиббса
- •Влияние температуры на поверхностное натяжение
- •Классификация пав
- •Образование и свойства растворов коллоидных поверхностно - активных веществ (ассоциативных коллоидов) –лиофильные коллоиды
- •Молекулярный раствор ↔ золь ↔ гель
- •Термодинамика мицеллообразования
- •Солюбилизация в растворах пав
- •Гидрофильно-липлофильный баланс (глб)
- •Оптические свойства коллоидных систем
- •Уравнение Рэлея
- •Адсорбция света
- •Нефелометрия
- •Турбидиметрия
- •Коллоидно-химические основы охраны природной среды
- •1 94021, Санкт-Петербург, Институтский пер., 5
Основы теории устойчивости дисперсных систем (длфо)
В наиболее общем виде эта теория устойчивости дисперсных систем изложена в работах Дерягина и Ландау в 1937 – 1941г. И несколько позднее к аналогичным выводам пришли голландские физики Фервей и Овербек. В честь этих учёных теория названа ДЛФО.
Согласно этой теории между частицами дисперсной фазы действуют силы молекулярного притяжения и силы отталкивания. Баланс этих сил (энергий) определяет результат встречи двух частиц дисперсной фазы. Коагуляция происходит, когда силы молекулярного притяжения (Um) между частицами превышают силы отталкивания (Uэл) - электростатическая природа сил. Расстояние между частицами – Н.
Обычно анализируют, как изменяется энергия взаимодействия в зависимости от расстояния между частицами.
Строят графики, характеризующие отдельно энергию притяжения и энергию отталкивания, как функцию расстояния. Общую энергию взаимодействия можно получить сложением ординат – их называют потенциальными кривыми. При их построении придерживаются правилом: энергия отталкивания считается положительной; а энергия притяжения - отрицательной.
Силы отталкивания не проявляют себя до тех пор, пока на значительном расстоянии, их диффузные слои (ионные атмосферы) не перекрываются. Природа сил отталкивания сложнее, чем кулоновское взаимодействие, в этом случае проявляется особого рода силы , так называемое расклинивающее давление (по Б. В. Дерягину).
Второй род сил, влияющих на устойчивость золей, - это силы притяжения между частицами. Т. е. силы Ван – дер - Вальса для реальных жидкостей или газов.
На рис. 18 показаны потенциальные кривые взаимодействия частиц при добавлении электролита.
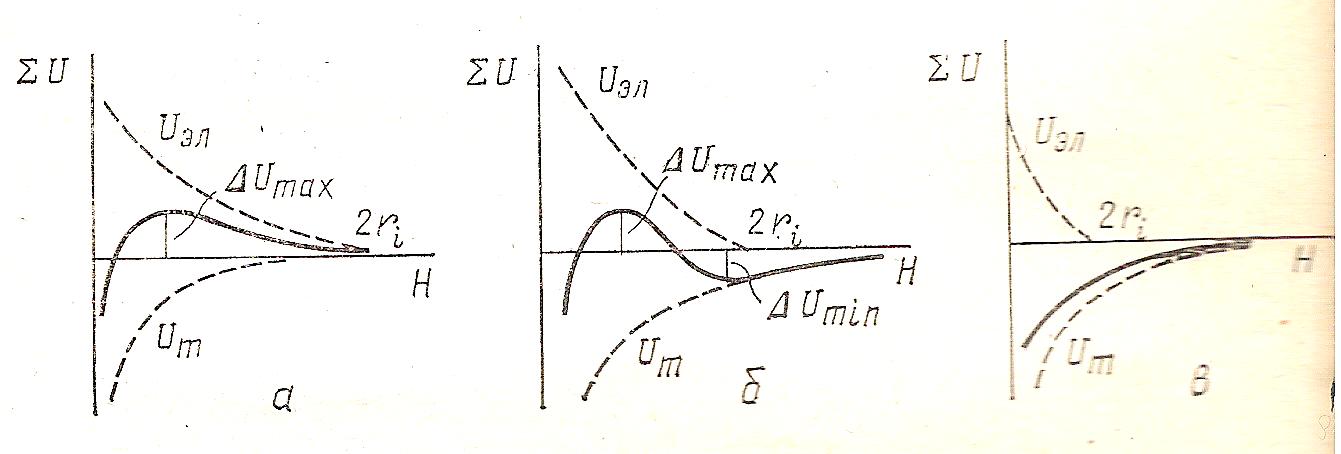
Рис.18. Потенциальные кривые взаимодействия частиц: а-агрегативно устойчивая система; б- коагуляция во вторичном энергетическом уровне; в –коагуляция во вторичном энергетическом уровне.
Рис.18а. Агрегативная устойчивость дисперсной системы.
Это состояние системы с высоким потенциальным барьером. При невысоком содержании электролита, меньше критической концентрации С < <Ск толщина ДЭС велика, преобладает энергия отталкивания. Потенциальный барьер ΔUmax больше, чем кинетической энергии самых быстрых частиц; они не могут подойти друг к другу и слипнуться. Система агрегативно устойчива. Значение потенциального барьера (обусловлено тепловым движение частиц) должно быть более 15 - 20 к∙Т ( к – постоянная Больцмана; Т – температура). Наблюдается энергетический максимум.
Рис. 18б. Коагуляция во втором энергетическом минимуме. При повышении концентрации электролита до величины ,большей критического значения С > Ск, Толщина ДЭС уменьшается. Кривая на рис.15 б. показывает на наличие высокого потенциального барьера и вторичного энергетического минимума, который обусловлен преобладанием энергии притяжения на далёких расстояниях, тогда как на близких расстояниях преобладает энергия отталкивания (ΔUmax ). Благодаря ΔUmax , частицы не имеют непосредственного контакта и разделены прослойками среды. Такое состояние называется обратимой коагуляцией. Вторичный энергетический минимум ΔUmin можно снизить или устранить пептизацией.
Рис.18в. Коагуляция в первичном энергетическом минимуме. Когда концентрации электролита на много превышает критическое значение С >> Ск толщина ДЭС становится недостаточной для предотвращения слипания частиц. Кривая показывает, что на всех расстояниях преобладает энергия притяжения. Происходит необратимая коагуляция в первичном энергетическом минимуме.
Следствие из теории ДЛФО.
Теория ДЛФО позволяет рассчитать порог коагуляции электролита Ск. Условие совпадения потенциальной кривой с осью абсцисс (когда отсутствует потенциальный барьер ΔUmax = 0 (рис.19).

Рис. 20. Потенциальная кривая взаимодействия частиц при С= Ск..
При решении этой системы уравнений можно определить критическую концентрацию коагуляции электролита (это закон шестой степени).
Uэл + Um = 0 = ΣU
dU / dH = 0
Ск= const/ z6. z – заряд иона – коагулятора. Приняв Ск , для однозарядного иона за единицу получаем, что коагулирующее действие иона тем сильнее , чем выше его заряд.
Ск 1/ Ск 2 /Ск 3 = 729 /11 /1. (12)
Экспериментальные и теоретические значения могут не совпадать вследствие специфической адсорбции электролитов золями.
Лекция 6
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ НА ГРАНИЦЕ ГАЗ - ЖИДКОСТЬ
Поверхностный слой находится в особых условиях, и поэтому обладает иными свойствами по сравнению с остальными частями системы. Основная причина этого различия заключается в том, что молекулы поверхностного слоя по-разному взаимодействуют с каждой фазой, т.к. в гетерогенной системе фазы отличаются либо природой, либо агрегатным состоянием. Поэтому равнодействующая сил, действующая на молекулы поверхностного слоя, не равна нулю и направлена в сторону той фазы, с которой поверхностные молекулы взаимодействуют сильнее.
Под толщиной поверхностного слоя понимают эффективную толщину, за пределами которой отклонение от локальных свойств от их объёмных значений становится несущественным.
Поверхностное натяжение.
Поверхностное натяжение имеет силовое и энергетическое определение (обозначается символом σ), имеет большое значение при изучении поверхностных явлений. Силовое определение поверхностного натяжения было дано Юнгом, который границу раздела между жидкостью и газом моделировал, как равномерно натянутую эластичную плёнку нулевой толщины. Поверхностное натяжение σ определялось как сила, действующая на единицу длины линии, лежащей на этой плёнке и по касательной к поверхности плёнки F = σ∙S (свободная поверхностная энергия стремится к минимуму).
В термодинамической теории поверхностных явлений поверхностное натяжение определяется иначе. При изменении поверхности разделе фаз происходит перенос молекул либо из объёма в поверхностный слой (при увеличении поверхности раздела фаз), либо в противоположном направлении (при сокращении поверхности). Так как равнодействующая межмолекулярных сил, действующих на молекулы поверхностного слоя, не равна нулю и направлена по нормали к поверхности, процесс изменения площади раздела фаз сопровождается совершением работы. При сокращении поверхности межмолекулярными силами совершается положительная работа, а для перевода молекул из объёма в поверхностный слой (увеличение поверхности) необходимо приложить внешние силы, работа такого процесса отрицательна.
В теории Гиббса поверхностное натяжение определяется, как работа по изменению площади поверхности на единицу в изотермическом обратимом процессе.
δA = - σ ∙dS , [н/м] или [Дж/м2]. (13)
Знак «минус» указывает на то, что увеличение поверхности (dS >0) сопровождается отрицательной работой.
Из этой формулы видно, что работа по изменению площади поверхности на единицу равна силе, действующей по касательной к единице длины линии, взятой на этой поверхности. Таким образом, силовое и термодинамическое определение (по теории Гиббса) эквивалентны.
Величина поверхностного натяжения служит мерой интенсивности сил взаимодействия между молекулами данного вещества. Известно, что у воды очень интенсивное межмолекулярные взаимодействия, а у этилового эфира эти взаимодействия очень слабые (поверхностное натяжение меньше у неполярных молекул, где слабые межмолекулярное связи).
Поверхностное натяжение зависит от температуры: с повышением температуры силы взаимодействия между молекулами ослабевают, поверхностное натяжение падает.
