
- •Кафедра технологии лесохимических продуктов, химии древесины и физической химии сПбГлту
- •Классификация по фазовому взаимодействию
- •II. Физическая конденсация
- •Строение двойного электричяеского слоя (дэс) и падение потенциала с расстоянием по теории т.Штерна
- •Элекирокинетические явления
- •Коагуляция
- •Кинетика коагуляции под действием электролитов
- •Основы теории устойчивости дисперсных систем (длфо)
- •Уравнение изотермы адсорбции Гиббса
- •Влияние температуры на поверхностное натяжение
- •Классификация пав
- •Образование и свойства растворов коллоидных поверхностно - активных веществ (ассоциативных коллоидов) –лиофильные коллоиды
- •Молекулярный раствор ↔ золь ↔ гель
- •Термодинамика мицеллообразования
- •Солюбилизация в растворах пав
- •Гидрофильно-липлофильный баланс (глб)
- •Оптические свойства коллоидных систем
- •Уравнение Рэлея
- •Адсорбция света
- •Нефелометрия
- •Турбидиметрия
- •Коллоидно-химические основы охраны природной среды
- •1 94021, Санкт-Петербург, Институтский пер., 5
Строение двойного электричяеского слоя (дэс) и падение потенциала с расстоянием по теории т.Штерна
На рис. 3 показано изменение потенциала в ДЭС на кристалле AgCl с увеличением расстояния от его поверхности. В пределах ДЭС действует AgCl электрическое поле, интенсивность которого характеризуется значением потенциала.
Потенциал на поверхности AgCl - φо – термодинамический потенциал. Он характеризует скачок потенциала на поверхности раздела между фазами.
Ионы плотного слоя (потивоионы) приближаются к поверхности расстояние, определяемое их собственными размерами. Воображаемая поверхность, проведённая через центр плотного слоя, называется плоскостью максимального приближения, она расположена на расстоянии ∆ порядка молекулярных размеров; потенциал плоскости максимального приближения характеризуется ψ (пси) – потенциалом.
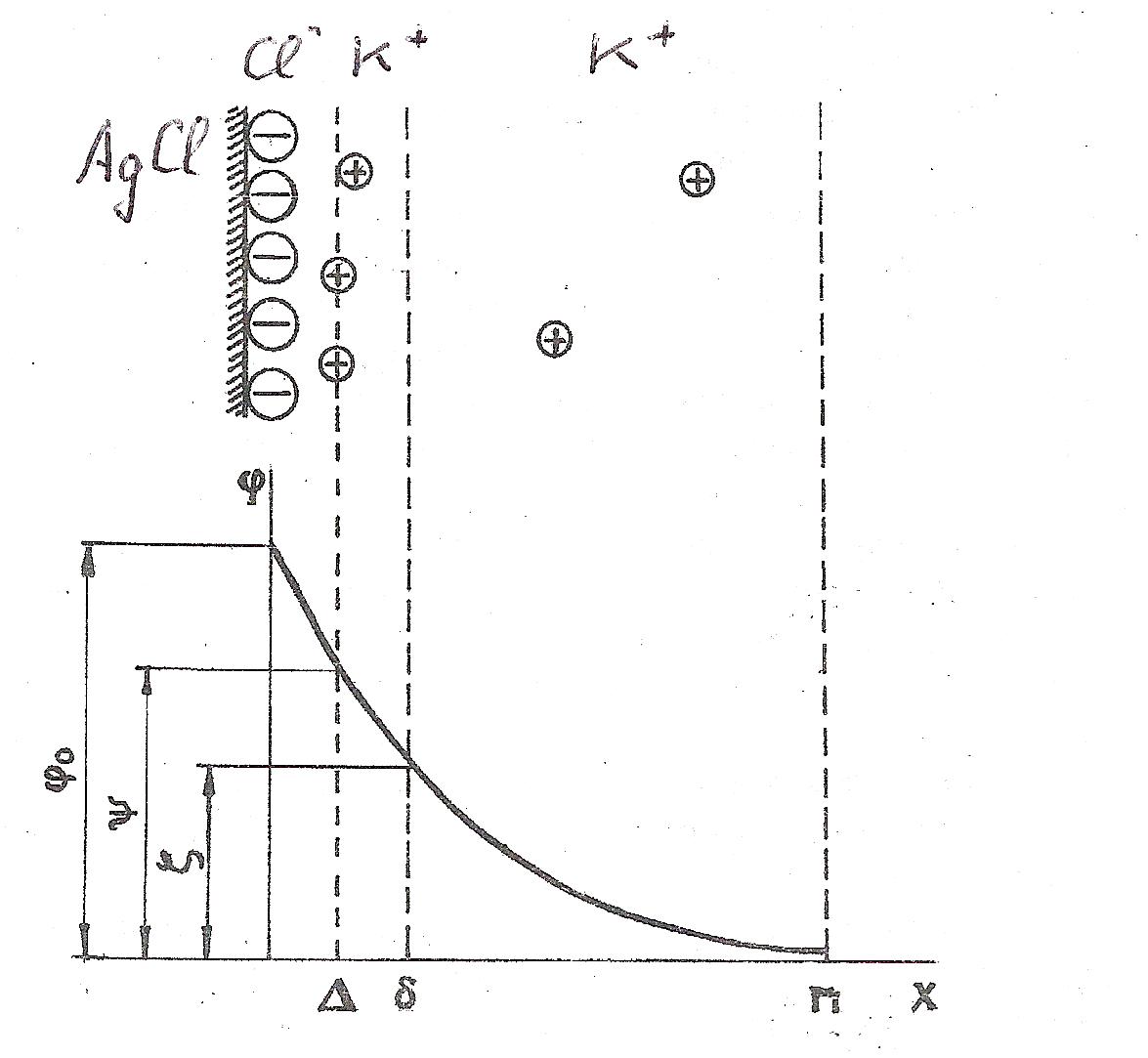
Рис. 3. Строение двойного электрического слоя на поверхности AgCl.
Смещение фаз твёрдой и жидкой относительно друг друга находится на некотором расстоянии от плоскости максимального приближения, и может быть несколько большим расстоянии δ от поверхности (это плоскость скольжения). Потенциал плоскости скольжения называют электрокинетическим или дзета (ζ ) - потенциалом. Здесь потенциал ещё не снижается до потенциала жидкой фазы. Этот потенциал и будет определять перемещение фаз при наложении постоянного электрического поля. Электрокинетический потенциал является частью общего скачка потенциала. Т. о. ясно, почему электрокинетический потенциал отличен от нуля, но не равен общему скачку потенциала.
Значение его зависит от числа не скомпенсированных зарядов адсорбционного слоя на поверхности скольжения, т. е. от числа ионов в диффузном слое. Падение потенциала в плотном слое имеет линейный характер
(по аналогии с ДЭС в плоском конденсаторе).
В диффузной части ДЭС изменение потенциала с расстоянием под∙
φ = φо ∙e - κ∙х.
где φо – потенциал поверхности; κ– параметр Дебая; 1/ k = ri - характеристическая толщина ионной атмосферы; х – расстояние от поверхности.
Очевидно, при х = 1/κ = ri φ = φо /e.
Согласно теории сильных электролитов радиус ионной атмосферы ri ограничивает действие электрического поля поверхности: на расстоянии х = ri потенциал поля убывает в e раз; а при х > ri стремится к нулю.
По теории Дебая – Гюккеля κ зависит от концентрации и заряда электролита в растворе:
κ = √ 2∙с ∙z2∙ e2 / ε∙εo ∙K∙T,
где с – концентрация электролита; z - заряд электролита; ε - диэлектрическая проницаемость раствора; εo - диэлектрическая постоянная (8.85∙ 10-12 Ф / м); K – константа Больцмана (1.38 ∙ 10-23 Дж/ K); Т – температура.
Так как радиус ионной атмосферы обратно пропорционален параметру Дебая, то при увеличении концентрации и заряда электролита ri должен уменьшаться и соответственно уменьшаться ДЭС коллоидной мицеллы. Рассмотрим явления, связанные с изменением ДЭС при введении в коллоидный раствор электролитов.
1. Влияние концентрации электролита на строение ДЭС.
С увеличением концентрации электролита диффузия противоионов в раствор уменьшается, т.к. уменьшается разность концентраций между диффузным слоем и раствором. Соответственно уменьшается и число ионов в диффузной части ДЭС, большее число ионов будет в плотном слое, что приведёт к снижению ζ – потенциала (см. рис. 4).
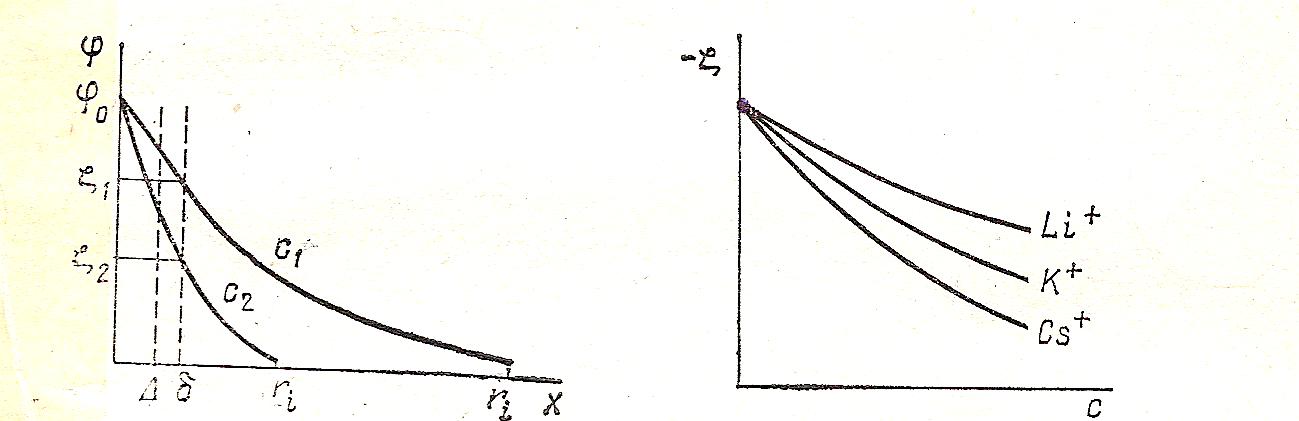
Рис.4.Влияние концентрации электролита Рис.5.Влияние радиуса
на ζ – потенциал. на ζ – потенциал.
2. Явление ионного обмена (обменная адсорбция) – ионы наружной кладки заменяются другими одноимёнными ионами, добавленными в раствор.
Было установлено, что активность к обменной адсорбции для неорганических ионов с одинаковым зарядом возрастает с уменьшением гидратации. Подобные ряды, в которых располагаются ионы одинакового заряда по уменьшению степени гидратации, называются лиотропными или рядами Гофмейстера.
Катионы и анионы располагаются следующим образом.
← Увеличение гидродинамического объёма (иона с гидратной оболочкой)
Li+ > Na+ > K + > Rb + > Cs+.
Mg 2+ > Ca2+ > Sr2+ > Ba2+.
Cl- > Br - > I - > CNS-.
→ Увеличение радиуса иона и его подвижности и, как следствие возрастание к поляризации.
Силовое поле тем больше, чем меньше радиус иона, значит сильнее взаимодействие с водой. Гидратация уменьшается с увеличением радиуса иона, следовательно, уменьшается гидродинамический объём, при этом ион легче, ближе подходит к поверхности и сильнее притягивается к ней. Т.е. любой член лиотропного ряда, попадая за счёт теплового движения в диффузный слой, вытесняет предыдущий. Например, если ионы К+ попадут в пределы диффузного слоя, состоящего из ионов Na+, то уйдут ионы Na+, т.к. они в меньшей степени будут притягиваться к поверхности, а ионы К+ сильнее.
Толщина ДЭС уменьшится (из-за уменьшения числа противоионов в диффузном слое). Соответственно уменьшится дзета-потенциал. На рис. 5 показано изменение дзета-потенциала для отрицательно заряженной частицы.
3. Способность к обменной адсорбции с увеличением заряда иона.
На рис.6 показано, что многовалентные ионы могут не только уменьшить величину дзета – потенциала, но и изменить на противоположный знак. Таким образом, поверхность перезарядится. Это объясняется более высокой специфической адсорбцией у ионов с большим зарядом по сравнению с ионами с более низким зарядом. Например, ионы Al 3+сильнее притягиваются к поверхности, чем одно- или двухзарядные ионы (заменяя ионы K + или Mg 2+). Затем при увеличении концентрации Al 3+ на поверхности частицы появляется избыточный положительный заряд. В итоге возникает новый ДЭС с положительными потенциалопределяющим ионами; дзета-потенцил становится положительным.
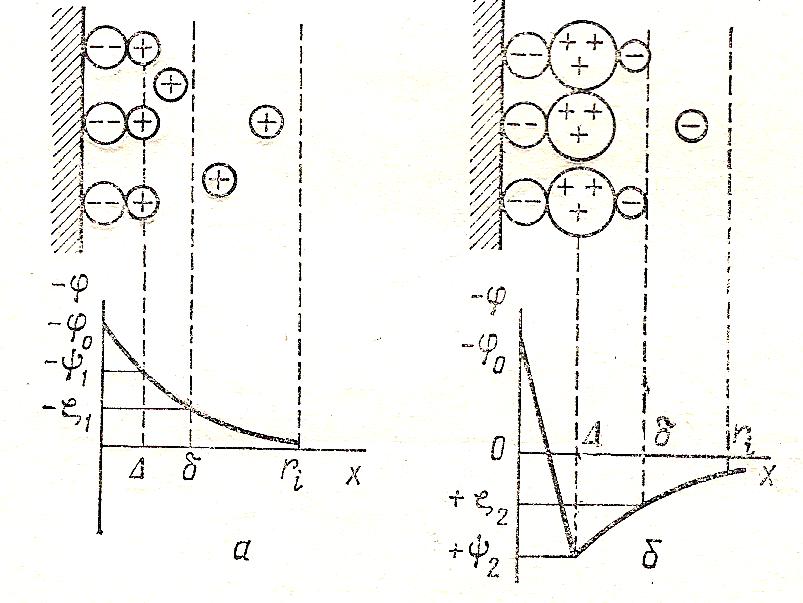
Рис.6. Строение ДЭС на поверхности стекла в воде до перезарядки (а) и после перезарядки поверхности трёхвалентными ионами (б).
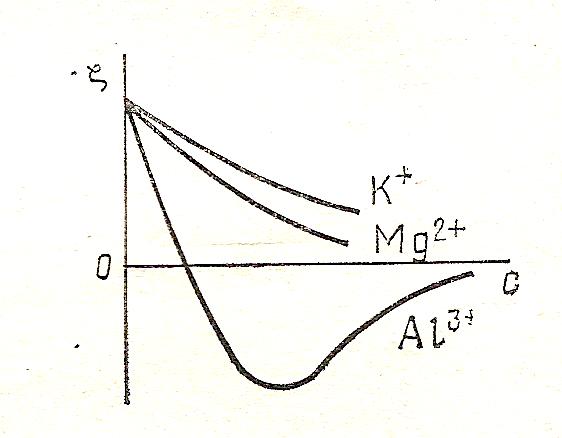
Рис. 7. Влияние валентности ионов на зависимость ζ – потенциал от концентрации.
Лекция 4
