
- •Кафедра технологии лесохимических продуктов, химии древесины и физической химии сПбГлту
- •Классификация по фазовому взаимодействию
- •II. Физическая конденсация
- •Строение двойного электричяеского слоя (дэс) и падение потенциала с расстоянием по теории т.Штерна
- •Элекирокинетические явления
- •Коагуляция
- •Кинетика коагуляции под действием электролитов
- •Основы теории устойчивости дисперсных систем (длфо)
- •Уравнение изотермы адсорбции Гиббса
- •Влияние температуры на поверхностное натяжение
- •Классификация пав
- •Образование и свойства растворов коллоидных поверхностно - активных веществ (ассоциативных коллоидов) –лиофильные коллоиды
- •Молекулярный раствор ↔ золь ↔ гель
- •Термодинамика мицеллообразования
- •Солюбилизация в растворах пав
- •Гидрофильно-липлофильный баланс (глб)
- •Оптические свойства коллоидных систем
- •Уравнение Рэлея
- •Адсорбция света
- •Нефелометрия
- •Турбидиметрия
- •Коллоидно-химические основы охраны природной среды
- •1 94021, Санкт-Петербург, Институтский пер., 5
II. Физическая конденсация
В основе способа лежит конденсация молекул одного вещества - будущей дисперсной фазы в другом веществе – будущей дисперсионной среде. Здесь возможны два пути.
1.Пропускание паров одного вещества в другое.
2.Метод замены растворителя. При этом понижается растворимости вещества, которое находилось в истинном растворе. Вливая спиртовой раствор серы в воду, получаем гидрозоль серы. Золь образуется в результате соединения молекул серы в коллоидные частицы, заряжается отрицательно. Таким же образом получают золи фосфора, канифоли, антрацена.
ДИСПЕРГАЦИОННЫЕ (ДИСПЕРСИОННЫЕ) МЕТОДЫ
1.Механическое дробление в мельницах (коллоидных, шаровых, вибрационных).
2. Ультразвуковым способом получают тонкое диспергирование за счёт разрывных усилий - чередующихся сжатий и расширений.
3.Электрическим методом в вольтовой дуге получают золи металлов.
Дробление до частиц мелких размеров требует затраты большой работы, т.к. поверхность раздела между фазами должна быть очень велика. Образующиеся частицы могут легко слипаться (коагулировать), поэтому дробление следует проводить в дисперсионной среде в присутствии стабилизаторов – ионов или поверхностно – активных веществ (ПАВ).
Дробление в присутствии ПАВ требует меньшей работы. Эффект значительного понижения сопротивляемости твёрдых тел был обнаружен П. А. Ребиндером. Он получил название – адсорбционное понижение прочности в результате абсорбции ПАВ на твердых частицах.
ПЕПТИЗАЦИЯ (ФИЗИКО–ХИМИЧЕСКОЕ ДРОБЛЕНИЕ ОСАДКОВ)
Пептизацией называют дробление рыхлых осадков, в которых имеются частицы дисперсной фазы, разделённые прослойками дисперсионной среды. Их непосредственному соприкосновению мешают либо двойные электрические слои, либо сольватные оболочки на поверхности частиц. Они обеспечивают отталкивание на близких расстояниях, а на более далёких преобладают силы межмолекулярного притяжения, не дающие частицам разойтись за счёт теплового движения. Прочность таких агрегатов в осадке невелика и связь между частицами может быть относительно легко разорвана.
Пептизировать такой осадок можно 3 способами.
1.Адсорбционная пептизация. Введение электролита – пептизатора вызовет его адсорбцию на поверхности частицы. При этом на частице толщина ДЭС увеличивается. Например, осадок Fe (ОН)3
Пептизируют солям FeCl3 , при действии которой потенциалобразующий ион Fe3+ адсорбируется поверхностью частиц Fe (ОН)3 ,на которых образуется ДЭС, что вызывает отталкивание частиц осадка , связь между ними разрывается, и под действием теплового движения частицы переходят в раствор.
2.Пептизация путём поверхностной диссоциации. Пептизатор способствует процессу диссоциации с поверхности, вызывая растворение соединений на частицах осадка. Пептизация этого типа подходит для амфотерных (амфолитных) коллоидов: Аl(0H)3 ,Sn(OH)4 ,Th(OH)2. В этом случае прибавляют кислоту или щёлочь.
Например, в слабокислой среде осадок пептизируется
Аl(0H)3 ↔ Аl(0H)2+ + НО-,
а в слабощёлочной
Аl(0H)3 ↔ Аl(0H)2О- +Н+.
Здесь Аl(0H)2+ и Аl(0H)2О- -потенциалобразующие ионы, а НО- и Н+ противоионы для коллоидных частиц с разным зарядом в зависимости от рН среды.
Таким образом, вокруг частицах осадка образуется ДЭС, способный преодолеть силы сцепления, и благодаря броуновского – теплового движения равномерно распределиться в объёме жидкости.
3.Пептизация путём промывания осадка. В результате промывания водой уменьшается количество электролита, вызвавшего коагуляцию. ДЭС на частицах расширится, силы отталкивания будут преобладать над силами притяжения. Осадок перейдёт в золь.
ОЧИСТКА КОЛЛОИДНЫХ РАСТВОРОВ. ДИАЛИЗ
Полученные тем или иным методом коллоидные растворы содержат, как правило, посторонние электролиты, снижающие их агрегативную устойчивость. Их удаляют методом диализа – очистка коллоидных растворов от низкомолекулярных примесей. Метод предложен Томасом Грэмом (1861г.), основанный на способности полупроницаемых мембран, отделяющих коллоидный раствор от внешнего раствора (чистой воды) пропускать частицы или молекулы малых размеров, но задерживать агрегаты частиц коллоидных размеров.
Мембраны: плёнки из целлюлозы, её эфиров (целлофан, коллодий - раствор нитроклетчатки в спирто – эфирной смеси), пергамент, кожа, керамика и другие материалы. Схема проточного диализатора показана на рис.1
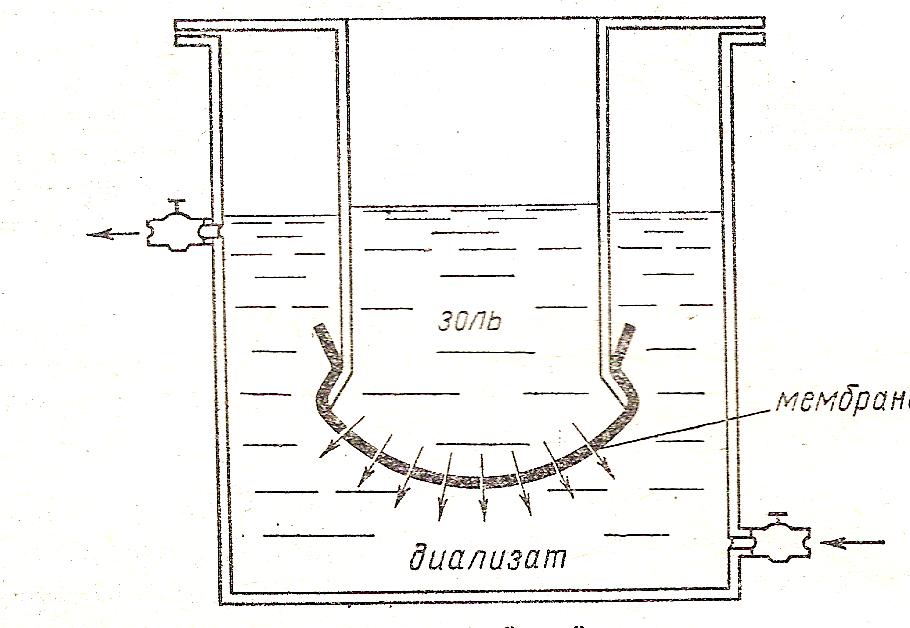
Рис. 1. Проточный диализатор.
Подлежащий очистке золь наливают в ячейку (мешочек) из какого-либо пористого материала (пергамент) и помещают в сосуд с дистиллированной водой. Частицы истинно растворимых веществ диффундируют через мембрану в воду. Очистка идёт до тех пор, пока концентрация низко - молекулярных примесей в золе и диализате не станет одинаковой.
Кинетика очистки метода диализа.
W = - d сt / t = δ S (ct – cd) ⁄ V,
где: W-скорость диализа,
сt - концентрация низкомолекулярного вещества в момент времени t,
cd - концентрация низкомолекулярного в диализате,
S – площадь мембраны,
V – объём золя в ячейке,
δ – коэффициент диализа, зависящий от вязкости среды, природы примесей и пористой мембраны.
Повысить скорость диализа можно за счёт повышения отношения S/V, а также повышения температуры до определённых пределов.
Применение диализа
1.Электродиализ (Рис. 2).
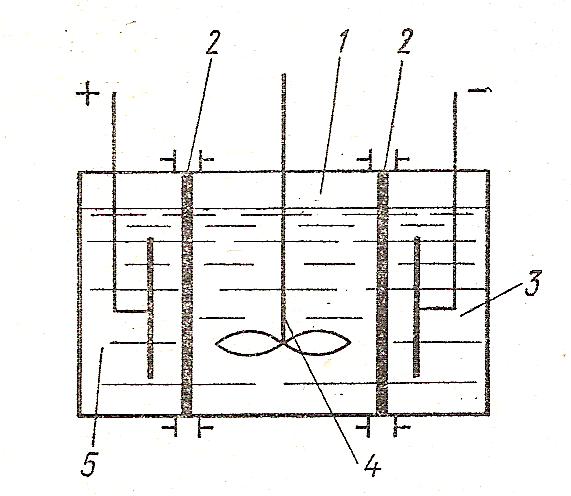
Рис.2. Схема устройства электродиализа. 1- камера для золя; 2- полупроницаемые мембраны; 4- мешалка; 3, 5 – боковые камеры.
В центральную камеру с мешалкой помещают золь, а боковые заполняют водой, в них находятся электроды (катод и анод). Под влиянием разности потенциалов катионы идут в катодную камеру через мембрану, а анионы в анодную тоже через другую мембрану. Очень эффективный способ очистки для опреснения морской воды и очистки речной или озёрной воды.
2. Гемодиализ. Удаление токсичных веществ из крови (искусственная почка). Здесь трубки из целлофана погружают в диализирующий раствор.
3. Ультрафильтрация. Метод очистки путём продавливания дисперсной системы через ультрафильтры (типа мембраны) при больших давлениях.
4. Комбинированные мет оды очистки. Например, ультрафильтрацию с электродиализом используют при разделении белков.
5.Электродекантация. Фильтрация под действием собственного веса с электродными камерами.
Лекция 3
ЭЛЕКТРИЧЕСКИЕ СВОЙСТВА КОЛЛОИДНЫХ СИСТЕМ
Двойной электрический слой (ДЭС). Образование мицеллы.
Возникновение ДЭС на поверхности частицы связано с переходом зарядов (ионов) из одной фазы в другую, что обусловлено различием в величине химического потенциала µ компонента (иона) в граничащих фазах. Ионы переходят из фазы с большим значением химического потенциала, в фазу где химический потенциал имеет меньшее значение. В результате на границе раздела фаз появляется скачок потенциала, который приостанавливает дальнейший переход ионов.
Существуют два пути образования ДЭС.
1.Адсорбционный. Например, адсорбция ионов на поверхности
Ag Cl. При взамодействии AgCl с избыт. КСl по реакции:
Ag NO 3- + изб КСl = AgCl ↓ + KNO3.
Здесь кристаллы AgCl находятся в равновесии с ионами К + , NO 3- и Cl-. Так как, µж Cl- > µтCl- , то и оны Cl- адсорбируются на поверхности AgCl, пока на границе раздела фаз не возникнет скачок потенциала, а поверхность приобретает отрицательный заряд (это потенциалопределяющие ионы).
Согласно правилу Фаянса – Панета на кристалле адсорбируются ионы, образующие с ионами кристалла трудно - растворимые соединения, они изоморфны кристаллу, т.е. способны достраивать его кристаллическую решётку. Учитывая, что КСl находится в системе в избытке, то ионы Cl- будут достраивать решётку AgCl за счёт химических сил. Оставшиеся ионы К + электростатически притягиваются к поверхности и восстанавливают нарушенную электронейтральность системы. Однако прочно они (К + ) не присоединяются ( образуют с поверхностными ионами растворимые соединения), а т.к. их концентрация около поверхности больше, чем в растворе, то они диффундируют в сторону с меньшей концентрац∙ией, т. е. от поверхности в раствор. На поверхности AgCl возникает ДЭС, состоящий из внутренней обкладки – адсорбционного слоя Cl- и , наружной обкладки или слоя противоионов К + . Часть противоионов К + связана с поверхностью кристалла AgCl относительно прочно и входит в состав плотного слоя; остальные противоионы, совершая тепловое движение около поверхности, образуют диффузную часть ДЭС (диффузный слой). Распределение противоионов между плотной и диффузной частями определяется соотношением между электростатическим притяжением ионов к поверхности и их диффузией в раствор. Диффузия определяется тепловым движением ионов в зависимости от разности концентраций К + в ДЭС и объёме раствора.
2.Второй путь образования ДЭС. Путём поверхностной диссоциации: например, на поверхности стекла. В воду из стекла переходят катионы
Na+ , K+ и т.д. В этом случае поверхность стекла заряжается отрицательно.
СТРОЕНИЕ МИЦЕЛЛЫ (по Н. П. Пескову)
Частица дисперсной фазы (кристалл) вместе с ДЭС называется мицеллой (mica- частица, крупинка).
Строение мицеллы определяется строением ДЭС. Для мицеллы хлористого серебра, полученной по реакции:
Ag NO 3- + изб КСl = AgCl ↓ + KNO3 ,формулу можно записать следующим образом.
Адсорбционный Диффузный
слой (плотный) слой
----------------- -----------
{n[AgCl] m Cl- (m-x) К + }x+ x К + , как правило n>m.
A . Пот. Связ. Своб.
-----------
Агрегат
-----------------
Ядро
-------------------------------
Коллоидная частица - гранула
А. – нерастворимый агрегат мицеллы.
Пот. – потенциалопределяющие ионы адсорбционного слоя.
Связ. – связанные противоионы адсорбционного слоя.
Своб. – свободные противоионы диффузного слоя.
Внутри мицеллы находится агрегат основного вещества. На поверхности агрегата расположены потенциалопределяющие ионы. Агрегат вместе с потенциалопределяющими ионами называется ядром мицеллы. Ядро с противоионами плотной части ДЭС образует гранулу. Гранулу окружают противоионы диффузного слоя.
Очевидно, если в избытке взять Ag NO 3- , то мицелла будет иметь другое строение:
{n[AgCl] m Ag+ (m-x) NO3 - }x- x NO3 -.
2.Второй путь образования ДЭС. Путём поверхностной диссоциации: например, на поверхности стекла. В воду из стекла переходят катионы
Na+ , K+ и т.д. В этом случае поверхность стекла заряжается отрицательно.
