
- •Кафедра технологии лесохимических продуктов, химии древесины и физической химии сПбГлту
- •Классификация по фазовому взаимодействию
- •II. Физическая конденсация
- •Строение двойного электричяеского слоя (дэс) и падение потенциала с расстоянием по теории т.Штерна
- •Элекирокинетические явления
- •Коагуляция
- •Кинетика коагуляции под действием электролитов
- •Основы теории устойчивости дисперсных систем (длфо)
- •Уравнение изотермы адсорбции Гиббса
- •Влияние температуры на поверхностное натяжение
- •Классификация пав
- •Образование и свойства растворов коллоидных поверхностно - активных веществ (ассоциативных коллоидов) –лиофильные коллоиды
- •Молекулярный раствор ↔ золь ↔ гель
- •Термодинамика мицеллообразования
- •Солюбилизация в растворах пав
- •Гидрофильно-липлофильный баланс (глб)
- •Оптические свойства коллоидных систем
- •Уравнение Рэлея
- •Адсорбция света
- •Нефелометрия
- •Турбидиметрия
- •Коллоидно-химические основы охраны природной среды
- •1 94021, Санкт-Петербург, Институтский пер., 5
Адсорбция света
Бугер, а затем Ламберт в 1760г. установили зависимость между интенсивностью прошедшего света и толщиной среды, через которую этот свет прошёл:
Іп = Іо ∙ekℓ, (27)
где: Іп и Іо - интенсивность прошедшего и падающего света;
ℓ - толщина поглощающего слоя; k – коэффициент поглощения среды.
Из закона Бугера – Ламберта видно, что если толщина растёт в арифметической прогрессии, то интенсивность прошедшего света уменьшается в геометрической прогрессии.
Бэр показал, что коэффициент поглощения для абсолютно бесцветных растворов пропорционален молярной концентрации С растворённого вещества.
k = ε∙С.
Вводя значение молярного коэффициента поглощения ε в уравнение Бугера – Ламберта закон Бугера – Ламберта – Бэра:
Іп = Іо ∙ek∙ℓ∙ С. (28)
Логарифмируя уравнение (28) получим:
ℓn (І 0 / Іп ) = k∙ℓ∙ С = D. (29)
Левую часть уравнения (29) называют оптической плотностью раствора D или экстинкцией. При работе с монохроматическим светом указывают длину волны, тогда оптическую плотность обозначают Dλ, индекс λ указывает длину волны света, применённого при определении.
Преобразуя выражение (29), получим:
(I0 – Iп )/I0 = 1 - ek∙ℓ∙ С. (30)
Левую часть выражения (30) называют относительным поглощением.
Молярный коэффициент поглощения, являющийся постоянной характеристикой для данного вещества, можно легко определить, если С = 1 и
ℓ = 1.
Тогда ε = ℓn (І 0 / Іп ). (31)
Если ε = 0, раствор не адсорбирует свет, то уравнение (28) примет вид
Іп = Іо, то есть интенсивность прошедшего света равна интенсивности падающего света.
Молярный коэффициент поглощения ε зависит от длины волны, адсорбируемого света, температуры и природы растворённого вещества и растворителя и, как правило, не зависит от концентрации раствора.
Закон Бугера – Ламберта – Бэра применим только для золей высокой дисперсности с низкой концентрацией, если только слой жидкости не слишком толст.
В заключении отметим, что существуют эффекты, напоминающие в некоторой степени опалесценцию (рассеивание света), это флуоресценция (свечение истинных растворов некоторых красителей, например, эозина). Опалесценция - это светорассеяние в типичных коллоидных системах, а флуоресценция - внутримолекулярное явление, заключающееся в селективном поглощении молекулами светового луча и в трансформировании его в световой луч большей длины.
В настоящее время оптическими методы служат ля определения размера, формы и структуры коллоидных высокодисперсных частиц. Их исследуют с помощью ультрамикроскопа, электронной микроскопии, нефелометра и турбидиметра. Грубые дисперсные системы (суспензии, эмульсии, пены) исследуют с помощью светового микроскопа.
Ультрамикроскопия
В 1903г. Зидентопф и Зигмонди предложили метод , основанный на наблюдении конуса Тиндаля. На коллоидную систему сбоку направляют сильный луч света и с помощью обычного микроскопа наблюдают свет, рассеянный от отдельных частиц. На тёмном фоне коллоидные частицы становятся светлыми, так как рассеивают свет. При проведении ультрамикроскопии необходимо соблюдать определённые условия.
1. Золь должен быть разбавлен, чтобы свет от отдельных частиц не сливался.
2.Частицы не должны быть очень малы и велики. В первом случае , их сложно наблюдать, а во втором случае, будут образовываться дифракционные кольца.
3.Должно быть сильное различие в коэффициенте дисперсной фазы и дисперсионной среды.
На рис.31 показана схема щелевого микроскопа.
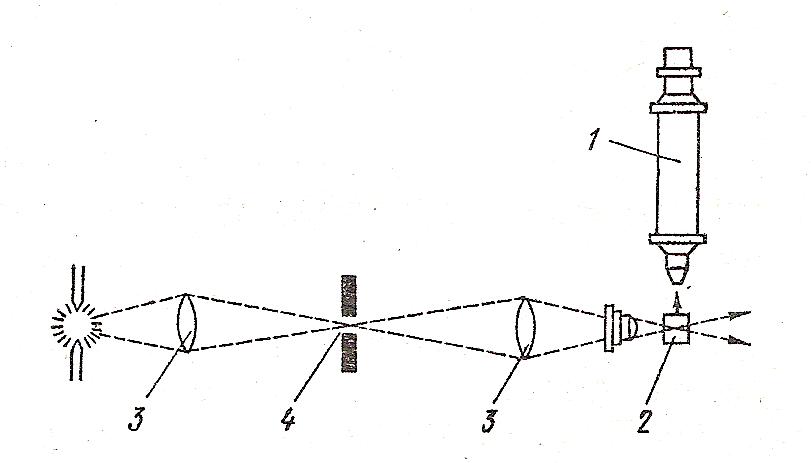
Рис. 31. Щелевой микроскоп:1- окуляр; 2- кювета с исследуемым золем; 3-фокусирующие линзы; 4- щелевая диафрагма.
Свет от дуговой лампы фокусируется линзами в системе, где частицы рассеивают свет. Затем определяют число частиц п в единице объёмаV ( количество светящихся точек).Таким образом определяют численную концентрацию ν = п /V.
Зная плотность дисперсной фазы ρ и весовую концентрацию золя С можно определить средний объём частицы (υ) : ν∙ ρ∙υ = С; υ= С/ν ρ.
Для шарообразной частицы: r = 3√3 υ/4π . Или для кубических частиц можно определить размер ребра:
ℓ= 3√3 υ.
К недостаткам ультрамикроскопии относится сложность при подсчёте частиц и то, что получается средний размер частицы.
В настоящее время широко применяется электронная микроскопия, подсчёт частиц осуществляет электронный прибор. Сложность определения в этом случае сводится к поддержанию в микроскопе высокий вакуум.
