
- •1.Кинетика химических реакций
- •1.1 Введение
- •1.2. Основные понятия
- •1.3. Элементарная стадия реакции
- •1.4. Сложные реакции
- •1.5. Скорость образования компонента
- •2. Формальная кинетика
- •2.1. Задача формальной кинетики
- •2.2. Закон действующих масс
- •2.3. Вычисление констант скоростей элементарных и формально простых гомогенных односторонних реакций в закрытых системах
- •2.4. Время полупревращения или полураспада
- •2.5. Способы определения порядка реакции для элементарных и формально простых реакций в закрытых системах
- •Метод избыточных концентраций (или метод Оствальда)
- •2.6. Зависимость скорости реакции от температуры
- •3. Катализ
- •3.1. Основные понятия
- •3.2. Каталитическая активность и селективность
- •3.3. Соотношение Бренстеда – Поляни
- •3.4. Кислотно-основный катализ
- •Специфический кислотно-основный катализ
- •Экспериментальная часть
- •5. Лабораторная работа № 2
- •Основы теории
- •Экспериментальная часть
- •Оглавление
- •1.Кинетика химических реакций
- •1.1. Введение…………………………………………………………….3
2.4. Время полупревращения или полураспада
Для характеристики реакций часто пользуются временем полупревращения или полураспада t1/2, равным промежутку времени, в течение которого реагирует половина взятого количества вещества. Особенно это важно для реакций первого порядка, к которым принадлежат реакции радиоактивного распада.
Для реакции I порядка, при С = 0,5 С0 подстановкой в уравнение получаем (10):
![]()
![]()
Т.е. время полупревращения не зависит от количества или концентрации исходного вещества и обратно пропорционально константе скорости реакции.
Для реакции второго порядка C = С0 – С = 0,5 С0, подставим в уравнение
(16):
![]()
![]()
12
В данном случае время полупревращения обратно пропорционально начальной концентрации исходного вещества.
Для реакции третьего порядка С = С0 – С = 0,5 С0, подставляем в уравнение
(19):
![]()
![]()
Здесь время полупревращения обратно пропорционально квадрату начальной концентрации исходных веществ (при условии равенства исходных концентраций веществ А1 и А2 и А3).
2.5. Способы определения порядка реакции для элементарных и формально простых реакций в закрытых системах
Рассмотрим простую реакцию n1-го порядка по А1 и n2 по А2:
![]()
![]()
Порядок реакции определяют, используя только опытные данные изменения концентрации реагирующих веществ со временем.
Зависимость скорости реакции от концентрации вычисляется по уравнению:
![]()
![]()
Общий порядок равен:
![]()
![]()
где n1– порядок по А1 и n2 – по А2, k – константа скорости реакции.
Если реакция (23) элементарная, то порядок реакции совпадает со стехиометрическими коэффициентами (а = а1 + а2).
Для того, чтобы скорость реакции зависела только от одного исходного вещества, используют метод избыточных концентраций.
Метод избыточных концентраций (или метод Оствальда)
13
Проводят серию опытов, в каждом из которых изучается влияние концентрации только одного из исходных веществ на скорость реакции. Для этого все остальные исходные вещества, берутся в
таком избытке по сравнению с исследуемым веществом, чтобы их концентрация была практически постоянной.
При протекании реакции считаем, что меняется только концентрация А1, а концентрация А2 остается постоянной, тогда:
![]()
![]()
где:
![]()
![]()
Затем берем избыток А1 по сравнению с А2 и получаем:
![]()
![]()
где:
![]()
![]()
Затем определяем порядок реакции по одному из ниже описанных методов.
Способы расчета порядка по данному веществу разделяются на дифференциальные и интегральные.
Дифференциальный способ.
На опыте получают зависимость концентрации вещества от времени. Скорость реакции определяют при помощи графического дифференцирования (путем проведения касательных в разных точках кинетической кривой). Т.е. находят тангенс угла этой касательной – это производная концентрации по времени (скорость образования данного вещества в данный момент времени).
1. Способ логарифмирования.
Прологарифмируем уравнение:
![]()
![]()
получим:
14
![]()
![]()
Тогда отрезок на оси ординат даст значение lnk, а тангенс угла наклона прямой – это порядок n1 реакции по веществу А1.
Аналогично проводят расчет с веществом А2, тогда общий суммарный порядок n = n1 + n2.
Основной недостаток метода – большая погрешность при определении тангенса угла наклона, достоинство – простота расчета.
Интегральные способы.
В этих способах используют выражения для зависимости концентрации вещества от времени, получаемые опытным путем или после интегрирования уравнений:
![]()
или
![]()
![]()
Способ подстановки.
Интегрируем уравнения (8), (14), (18) в пределах от 0 до t и от С0 до С
при n = 1, 2, 3
получаем:
![]() при n
= 1
при n
= 1
![]() при n
= 2
при n
= 2
 при n
= 3
при n
= 3
где С0 – начальная концентрация.
Подставляя в эти уравнения значение концентраций исследуемого вещества в разные моменты времени, вычисляем k. Порядок реакции будет соответствовать тому уравнению, где значение k останутся постоянными.
15
Рассчитывая порядок по данному исходному веществу, перечисленными ниже способами, определяем определяем общий порядок реакции, а затем константу скорости реакции
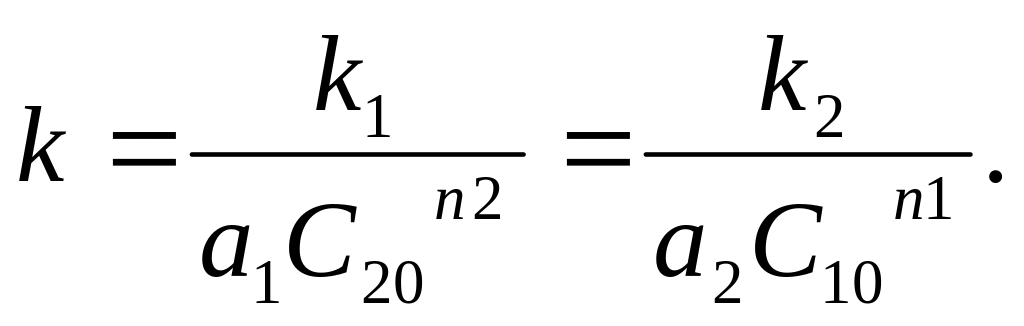
![]()
Графический метод.
Ниже приведены дифференциальные уравнения скоростей реакций различных порядков и их решения.
Порядок Уравнение скорости Решение уравнения
реакции
n
= 1
![]()
![]()
n
= 2
![]()
![]()
n
= 3
![]()
![]()
Отложив на оси абцисс время t, а на оси ординат lnC, 1/С и 1/С2 для изучаемой реакции получают зависимости, и та из них, которая соответствует порядку данной реакции, будет прямой.
3.Определение времени полупревращения.
Подставляя в уравнение (20), (21) и (22)
С = 0,5 С0, получаем:
![]() при n
= 1
при n
= 1
![]() при n
= 2
при n
= 2
16
![]() при n
= 3
при n
= 3
Проводим несколько опытов при разных начальных концентрациях. Как видно, при n = 1 время полупревращения не
зависит от C0; при n = 2 – обратно пропорционально С0; а при n = 3 – обратно пропорционально квадрату С0.
По характеру этих зависимостей делаем вывод о порядке реакции.
4. Способ Вант - Гоффа.
Если порядок нецелочисленный, то общее уравнение для t1/2:
![]()
Логарифмируя это уравнение, получим:
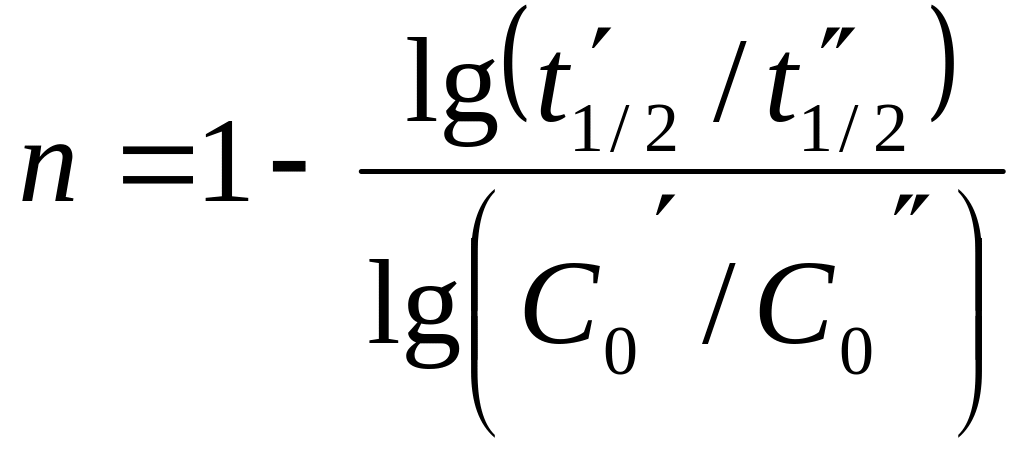 ,
,
где C'0 и C"0 – два значения концентраций компонентов соответствующих t'1/2 и t"1/2.
